
| A. | 15% | B. | 10.05% | C. | 9.5% | D. | 5% |
分析 甲烷与氧气的反应方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,当甲烷与氧气体积之比为1:2时,发生最强烈爆炸,设混合气体的体积为100L,甲烷体积为VL,消耗O2的体积为2VL,则空气体积(100-V)L,根据氧气在空气的体积分数列式计算出V,进而计算甲烷的体积分数.
解答 解:根据CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O可知,当甲烷与氧气体积之比为1:2时,发生最强烈爆炸,
设混合气体的体积为100L,甲烷体积为VL,消耗O2的体积为2VL,则空气体积(100-V)L,
则(100-V)×21%=2V,解得V=9.5L,
所以发生爆炸最强烈时,甲烷在空气中所占的体积分数为:$\frac{9.5L}{100L}$×100%=9.5%,
故选:C.
点评 本题考查混合物反应的计算、根据化学方程式计算,难度不大,关键根据方程式确定甲烷与氧气体积之比为1:2时发生最强烈爆炸.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
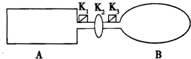 如图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量的1molNO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L.已知:2NO2(g)?N2O4(g)△H<0
如图装置中,A是由导热材料制成的密闭容器,B是耐化学腐蚀且易于传热的透明气球,关闭K2,将等量的1molNO2通过K1、K3分别充A、B中,反应起始时,A、B的体积相同均为a L.已知:2NO2(g)?N2O4(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na 着火可以使用泡沫灭火器 | |
| B. | 绿色化学是指有毒气体尾气要经过无毒处理后在排放 | |
| C. | 实验室用浓硫酸溶解铜制备硫酸铜 | |
| D. | 实验室可以适当温度下,使铜片在持续通入空气的稀硫酸中溶解的方法制备硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知水在25℃和95℃时,其电离平衡曲线如图所示.
已知水在25℃和95℃时,其电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| B. | SO2+2H2S═3S+2H2O | |
| C. | 3NO2+H2O═2HNO3+NO | |
| D. | 3S+6KOH═2K2S+K2SO3+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com