
【题目】反应4NH3+5O2![]() 4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率表达正确的是( )
4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率表达正确的是( )
A.v(O2)=0.01 molL-1s-1 B.v(NO)=0.008 molL-1s-1
C.v(H2O)=0.003 molL-1s-1 D.v(NH3)=0.004 molL-1s-1
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
①12.4g白磷晶体中含有的P﹣P键数约是0.6NA;
②电解精炼铜时转移了NA个电子,阳极溶解32g铜;
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA;
④2mol SO2和1mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA;
⑤2.9g 2CaSO4H2O含有的结晶水分子数为0.02NA (2CaSO4H2O式量为290);
⑥1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒;
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA.
A.①②③④⑤⑦ B.②③⑤⑥ C.①③④⑤⑥ D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
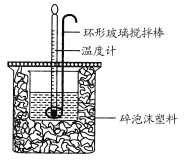
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?_________________________
(2)倒入NaOH溶液的正确操作是______________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是______________(填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______________。
(5)______________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,下列各组热化学方程式中,△H1<△H2是( )
A.C(s)+![]() O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
B.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g); △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,不正确的是( )
A.苯、乙醇和乙酸都能发生取代反应
B.液化石油气和天然气的主要成分都是甲烷
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.用新制的Cu(OH)2悬浊液可检验尿液中的葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度 T 时水的离子积常数为 Kw,该温度下,将浓度为 amol/L 的一元酸HA 与 bmol/L 的一元碱 BOH 等体积混合,可判断该溶液呈中性的依据是:
A.a=b
B.混合溶液的 pH 值为 7
C.混合溶液中C(H+)=![]()
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[ Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量 Mg(ClO3)2·6H2O 的流程如下:
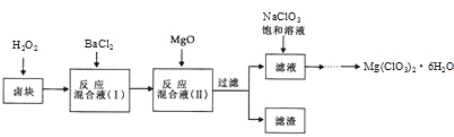
已知:①.卤块主要成分为 MgCl2·6H2O,含有 MgSO4、FeCl2等杂质。
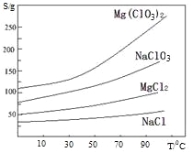
②.四种化合物的溶解度(S)随温度(T)变化曲线 如图所示。回答下列问题:
(1).过滤时主要的玻璃仪器有
(2).加入 BaCl2 的目的是除去杂质离子,检验已沉淀完全的方法是
( 3) .加入 H2O2 溶 液 的 作 用 是 : ; 加 入 MgO的 作 用是
(4).滤渣的主要成分为 。
(5).向滤液中加入 NaClO3 饱和溶液后,发生反应的化学方程式为:MgCl2+2NaClO3= Mg(ClO3)2↓+2NaCl,再进一步制取 Mg(ClO3)2·6H2O 的实 验步骤依次为① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(6).产品中 Mg(ClO3)2·6H2O 含量的测定:
步骤 1:准确称量 3.50 g 产品配成 100 mL 溶液。
步骤 2:取 10.00 mL 于锥形瓶中,加入 10.00 mL 稀硫酸和 20.00mL 1.000 mol·L-1 的 FeSO4溶液,微热。
步骤 3:冷却至室温,用 0.l000mol·L-1 K2Cr2O7 溶液滴定剩余的Fe2+至终点,
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
步骤 4:将步骤 2、3 重复两次,计算得平均消耗 K2Cr2O7 溶液 15.00 mL。
写出步骤 2 中发生反应的离子方程式(还原产物为Cl- )
产品中 Mg(ClO3)2·6H2O 的质量分数为【Mg(ClO3)2·6H2O 的相对分子质量为299,列出表达式即可)】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
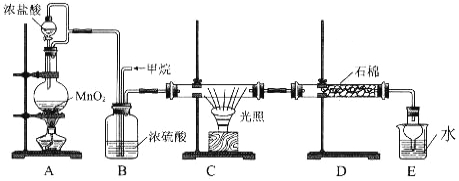
(1)A 中制取 C12 反应的离子方程式是 。
(2)B 装置中浓硫酸的作用是 。
(3)D 装置中的石棉上吸附着潮湿的 KI 粉末,其作用是 。
(4)E 装置的作用是 (填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E 装置中除了有盐酸生成外,还含有有机物,从 E 中分离出盐酸的最佳方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )
A.Ag和AgCl溶液 B.Ag和AgNO3溶液
C.Pt和Ag2CO3溶液 D.Pt和Ag2SO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com