
���� ˮ�õ��ӻ��ϼ۽���ʱ����������ʧ���ӻ��ϼ�����ʱ����ԭ����ˮ��Ԫ�ػ��ϼۼ������ֽ���ʱ���������ͻ�ԭ�����Ȳ�����Ҳ������ʱ�Ȳ����������ֲ�����ԭ����
��� �⣺A.2F2+2H2O=4HF+O2��ˮ��OԪ�ػ��ϼ���-2�۱�Ϊ0�ۣ���ˮ����ԭ����
B.2Na+2H2O=2NaOH+H2����ˮ��HԪ�ػ��ϼ���+1�۱�Ϊ0�ۣ���ˮ����������
C��CaO+H2O=Ca��OH��2�и�Ԫ�ػ��ϼ۲��䣬����������ԭ��Ӧ��
D.2H2O$\frac{\underline{\;һ������\;}}{\;}$2H2��+O2����ˮ��OԪ�ػ��ϼ���-2�۱�Ϊ0�ۣ�HԪ�ػ��ϼ���+1�۱�Ϊ0�ۣ�����ˮ�������������ǻ�ԭ����
E��3NO2+H2O=2HNO3+NO��ˮ�и�Ԫ�ػ��ϼ۲��䣬NԪ�ػ��ϼ���+4�۱�Ϊ+2�ۡ�+5�ۣ�����ˮ�Ȳ����������ֲ��ǻ�ԭ����
��ˮֻ������������B��ˮֻ����ԭ������A��ˮ����������������ԭ������D��ˮ�Ȳ����������ֲ�����ԭ����������ԭ��Ӧ��E��
�ʴ�Ϊ��B��A��E��
���� ���⿼����������ԭ��Ӧ������Ԫ�ػ��ϼ۱仯��ϻ�������ɽ��֪������Ԫ�ػ��ϼۣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
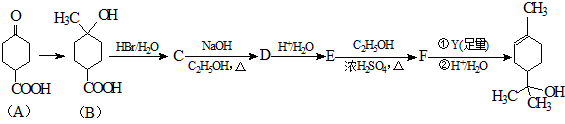
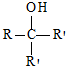
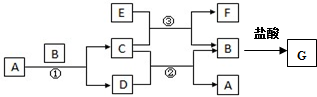
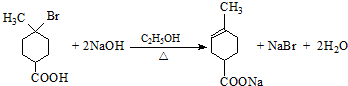 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪ˮ��25���95��ʱ�������ƽ��������ͼ��ʾ��
��֪ˮ��25���95��ʱ�������ƽ��������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �ڢۢ� | C�� | �ۢܢ� | D�� | �٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶ȣ�K��CO2 ת���ʣ�%�� n��H2��/n��CO2�� | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com