
| ���� | CO | H2 | N2 | O2 |
| �����L�� | 25 | 60 | 15 | 2.5 |
| VO2 |
| VN2 |
| 1000L |
| 22.4L/mol |
|
| VO2 |
| VN2 |
| 7.5+2.5 |
| 15 |
| 2 |
| 3 |
| 2 |
| 3 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ���� |
| ���¸�ѹ |
| ���� |
| ���¸�ѹ |
| ԭ�� | ��Ȼ�� | ���� | ú |
| ���Ͷ�ʷ��� | 1.0 | 1.5 | 2.0 |
| ��������/J?t-1 | 28109 | 38109 | 48109 |
| ||
| ���� |
| ||
| ���� |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| �������� | ���� | ���� | ���� | ���� | ��� | ��� | ��� |
| �е�/�� | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| ԭ�� | ��Ȼ�� | ���� | ú |
| ���Ͷ�ʷ��� | 1.0 | 1.5 | 2.0 |
| ��������/J?t-1 | 28��109 | 38��109 | 48��109 |
| ||
| ���� |
| ||
| ���� |
| NH3����% ѹǿ/MPa �¶�/�� |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3�ġ�H
2NH3�ġ�H| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��11�֣����ڹ�����ռ����Ҫ�ĵ�λ��2008�꣬�ҹ��������ӽ�500��֡���ͼ�Ǻϳɰ��ļ�Ҫ���̡�
��1����Ȼ�������͡�ú��������ˮ��Ӧ�Ƶ��������±���ij�ϳɰ������ò�ͬԭ�ϵ����Ͷ�ʺ��������ġ�
| ԭ��[ | ��Ȼ�� | ���� | ú |
| ���Ͷ�ʷ��� | 1.0 | 1.5 | 2.0 |
| ��������/J��t��1 | 28 | 38 | 48 |
�������ϱ���Ϣ������Ϊ���� Ϊԭ����á�
����д�������ڸ��¡���������������ˮ������Ӧ����������һ����̼�Ļ�ѧ����ʽ�� ��
����֪C��s����CO��g����H2��g����ȫȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ��
C��s��+O2��g��===CO2��g�� ��H=-394kJ��mol��1��
2CO��g��+O2��g��===2CO2��g����H=-566kJ��mol��1��
2H2��g��+O2��g��===2H2O��g�� ��H=-484 kJ��mol��1��
��д����C��ˮ�����ڸ��������·�Ӧ����������һ����̼���Ȼ�ѧ����ʽ ��
��2���±�����ij�ִ����������������Ϊ1��3�ĵ�����������ӦӦ�ﵽƽ��ʱ��һЩʵ�����ݡ�
�����ݱ��������жϣ��ϳɰ���ӦN2+3H2NH3�ġ�H 0��������������������жϡ�
![]() �����Ҫ˵������ ��
�����Ҫ˵������ ��
�ڸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
����300�桢10MPa�£��ϳɰ���Ӧ�ﵽƽ��ʱ��������������Ƿ�Ӧ��ʼʱ�� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�걱���г�����������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��Ȼ�����Լ���ƣ��ڹ�ҵ��������;�㷺��
�����Ʊ��ϳɰ�ԭ����H2 �е�Ӧ��
��1����������ת������H2����Ҫת����Ӧ���£�
CH4(g) + H2O(g)  CO(g)
+ 3H2(g) ��H = +206.2 kJ/mol
CO(g)
+ 3H2(g) ��H = +206.2 kJ/mol
CH4(g) + 2H2O(g)  CO2(g)
+4H2(g) ��H = +165.0kJ/mol
CO2(g)
+4H2(g) ��H = +165.0kJ/mol
������Ӧ����ԭ�����е�CO��ʹ���ϳɴ����ж��������ȥ����ҵ�ϳ����ô���������CO��ˮ������Ӧ�����׳�ȥ��CO2��ͬʱ�ֿ��Ƶõ�����������ķ������˷�Ӧ��Ϊһ����̼�任��Ӧ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��2��CO�任��Ӧ�������ȣ�ˮ������ԭ������CO���ʵ���֮�ȣ���COƽ��任��
����ת����һ����̼����任ǰһ����̼��֮�ȣ��Ĺ�ϵ����ͼ��ʾ��
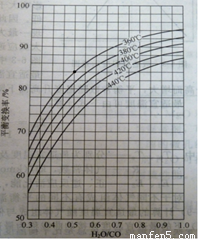
��������COƽ��任�ʵĹ�ϵ
��ͼ��֪��
�� ��ͬ�¶�ʱ��COƽ��任���������ȵĹ�ϵ�� ��
�� ��������ͬʱ��COƽ��任�����¶ȵĹ�ϵ�� ��
��3���������෴Ӧ����ij��֣�B����ƽ��ѹǿ��pB���������ʵ���Ũ��Ҳ���Ա�ʾƽ�ⳣ��������Kp������CO�任��Ӧ��ƽ�ⳣ����ʾʽΪ��Kp= �����¶ȵĽ��ͣ���ƽ�ⳣ�� ���������С�����䡱����
��������̼����ȼ�ϵ���е�Ӧ��
������Li2CO3��K2CO3Ϊ����ʣ���Ȼ�����������������ṩ��Ӧ����ȼ�ϵ��ʾ��ͼ���£�
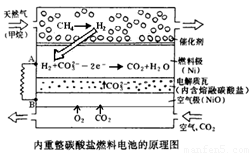
��1�����·�������������� ���� ������ĸ����
��2��������������Ӧ�����ӷ���ʽ�� ��
��3���Դ�ȼ�ϵ��Ϊ��Դ��⾫��ͭ������·��0.6 mol e‑ ת�ƣ��� g ��ͭ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com