
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________。
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
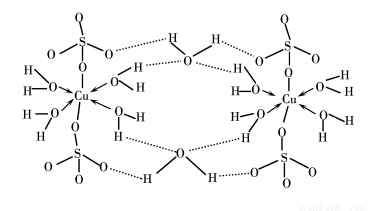
下列说法正确的是________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与
NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________________________________________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因_________________________________________________________________。
(1)1s22s22p63s23p63d9或[Ar]3d9
(2)4
(3)BD
(4)F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子。
(5)高 Cu2O与Cu2S相比,阳离子相同、阴离子所带电荷也相同,但O2-的半径比S2-小,所以Cu2O的晶格能更大,熔点更高。
【解析】(1)电子排布为结构化学中的重点。特别是24号、29号等存在半满和全满状态的元素。Cu2+应先写出Cu原子的电子排布,然后从外向内失去2个电子。
(2)对O2-个数的计算,面上的按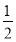 算,顶点上按
算,顶点上按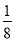 算,棱上按
算,棱上按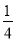 算,体心按1个算,可得O2-个数为:
算,体心按1个算,可得O2-个数为: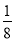 ×8+
×8+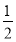 ×2+
×2+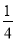 ×4+1=4(个)。
×4+1=4(个)。
(3)H2O中氧原子采用sp3杂化,SO42-中的氧不是。CuSO4应是离子晶体,不是分子晶体。
(4)NH3中是N原子提供孤对电子,Cu2+提供空轨道,形成配位键,而NF3中N原子的孤对电子被N原子核吸引。
(5)离子晶体中,离子键越短,离子键越强,离子化合物熔点越高。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源:2014年高二鲁科选修3化学训练1.2.2核外电子排布元素周期表练习卷(解析版) 题型:选择题
下列四种元素中,其单质氧化性最强的是( )。
A.原子含有未成对电子最多的第2周期元素
B.位于周期表第3周期ⅢA族的元素
C.原子最外电子层排布式为2s22p6的元素
D.原子最外电子层排布式为3s23p5的元素
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2章化学键分子间作用力练习卷(解析版) 题型:选择题
下列用电子式表示形成过程正确的是 ( )。
A.H∶H+······―→2H····
B.
C.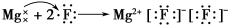
D.
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.3离子键配位键与金属键练习卷(解析版) 题型:选择题
下列元素的原子在形成不同物质时,既能形成离子键,又能形成极性键和非极性键的是( )。
A.Na B.Mg C.Ne D.Cl
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(解析版) 题型:选择题
如图在乙烯分子中有5个σ键、一个π键,它们分别是( )。
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键
D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.3原子晶体与分子晶体练习卷(解析版) 题型:选择题
下列晶体中由原子直接构成的单质有( )。
A.硫 B.生铁 C.金刚石 D.金属镁
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.2金属晶体与离子晶体练习卷(解析版) 题型:填空题
今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的原子外围电子构型为ns2npn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38∶77,据上可推知:
(1)X________,Y________,Z________(写元素符号)。
(2)X2Y2是________晶体,构成晶体的微粒是________,该晶体中含有________(填其微粒间作用)。
(3)Z的硫化物和氯化物的分子空间构型分别是__________、________,其中Z原子分别以________、________杂化轨道成键,按照成键方式来分类,Z的硫化物中的共价键类型和数目是___________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.1认识晶体练习卷(解析版) 题型:选择题
水的状态除了气、液和固态外,还有玻璃态,它是由液态水急速冷却到165 K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同。有关玻璃态水的叙述正确的是( )。
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.玻璃态水是分子晶体
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 模块综合检测练习卷(解析版) 题型:选择题
下列有关物质的性质或应用的说法不正确的是( )。
A.二氧化硅是生产光纤制品的基本原料
B.水玻璃可用于生产黏合剂和防火剂
C.盐析可提纯蛋白质并保持其生理活性
D.石油分馏可获得乙烯、丙烯和丁二烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com