
| A. | PbO2作正极,电极发生氧化反应 | |
| B. | 当转移的电子数为3.01×1023时,参与反应的Pb的质量为103.5 g | |
| C. | 负极的电极反应式是:Pb+SO42--2e-═PbSO4 | |
| D. | 溶液中H+移向负极 |
分析 该原电池放电时,正极反应式为PbO2+4H++SO42--2e-═2H2O+PbSO4,负极反应式为Pb+SO42--2e-═PbSO4,
A.PbO2作正极,得电子的物质发生还原反应;
B.根据Pb+SO42--2e-═PbSO4计算消耗Pb的质量;
C.负极上Pb失电子发生氧化反应;
D.放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动.
解答 解:该原电池放电时,正极反应式为PbO2+4H++SO42--2e-═2H2O+PbSO4,负极反应式为Pb+SO42--2e-═PbSO4,
A.PbO2作正极,正极反应式为PbO2+4H++SO42--2e-═2H2O+PbSO4,二氧化铅得电子发生还原反应,故A错误;
B.当转移的电子数为3.01×1023时,转移电子物质的量是0.5mol,根据Pb+SO42--2e-═PbSO4得消耗n(Pb)=$\frac{0.5mol}{2}×1$=0.25mol,消耗Pb质量=0.25mol×207g/mol=51.75g,故B错误;
C.负极上Pb失电子发生氧化反应,电极反应式为Pb+SO42--2e-═PbSO4,故C正确;
D.放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动,所以溶液中H+移向正极,故D错误;
故选C.
点评 本题考查原电池原理,为高频考点,明确正负极与元素化合价变化关系是解本题关键,难点是电极反应式的书写及有关计算,注意电解质溶液中阴阳离子移动方向,为易错点.


科目:高中化学 来源: 题型:解答题
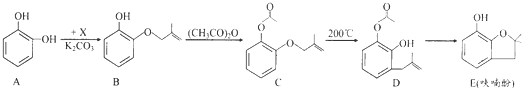
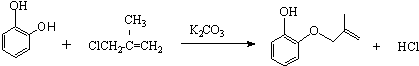 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{12}C$ 与${\;}_{\;}^{14}C$互为同素异形体 | |
| B. | 金刚石与石墨互为同位素 | |
| C. | 二甲醚与乙醇互为同分异构体 | |
| D. | 乙烷与乙烯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲溶液含有Ba2+ | B. | 乙溶液不含SO42- | C. | 丙溶液含有HCO3- | D. | 丁溶液含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
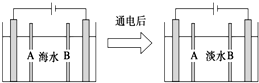
| A. | 阳离子交换膜是A,不是B | |
| B. | 通电后阳极区的电极反应式:2Cl--2e-═Cl2↑ | |
| C. | 工业上阴极使用铁丝网代替石墨碳棒,增大反应接触面 | |
| D. | 阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应产生H2的溶液中:Na+、K+、S2-、CO32- | |
| B. | 加入酚酞显红色的溶液中:K+、Na+、Cl-、CH3COO- | |
| C. | pH=2的溶液中:NH4+、Na+、Fe2+、NO3-、Cl- | |
| D. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Na+、Cl-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | HCO3- | C. | Fe3+ | D. | OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、Na+、ClO、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | Mg2+、NH4+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com