

分析 (1)①先沉淀、再过滤,最后消毒处理;
②将待处理水的pH调到9左右,再加入绿矾,可得到铁离子,水解生成胶体;
③对自来水进行杀菌消毒,且不会造成二次污染,只有臭氧的还原产物对水无污染;
④Na2CO3溶液的浓度为2.8×10-5mol/L,等体积混合后溶液中c(CO32-)=1.4×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+);
(2)含Cr3+、Fe2+、Ca2+等离子的废水加入过氧化氢,可氧化Fe2+生成Fe3+,然后加入NaOH溶液调节pH=8可除去Cr3+、Fe3+,过滤后滤液用钠离子交换树脂除去Ca2+,最后用活性炭吸附溶解在水中的杂质,并除去水中的异味,可得用于日常生活的净化水,以此解答该题.
解答 解:(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是混凝沉淀→过滤→杀菌消毒,故答案为:bca;
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加绿矾,原因:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-=4Fe(OH)3(胶体),
故答案为:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-=4Fe(OH)2(胶体);
③福尔马林有毒,含氯物质可导致二次污染,则能够用来对自来水进行杀菌消毒,且不会造成二次污染的只有臭氧,故答案为:d;
④Na2CO3溶液的浓度为5.6×10-5mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×5.6×10-5mol/L=2.8×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{2.8×1{0}^{-5}}$mol/L=1×10-4mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×10-4mol/L=2×10-4mol/L,故答案为:2.0×10-4mol•L-1;
(2)含Cr3+、Fe2+、Ca2+等离子的废水加入过氧化氢,可氧化Fe2+生成Fe3+,然后加入NaOH溶液调节pH=8可除去Cr3+、Fe3+,过滤后滤液用钠离子交换树脂除去Ca2+,最后用活性炭吸附溶解在水中的杂质,并除去水中的异味,可得用于日常生活的净化水,
①过氧化氢可氧化Fe2+生成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②过滤常用到的玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
③活性炭具有吸附作用,可吸附溶解在水中的杂质,并除去水中的异味,故答案为:吸附溶液在水中的杂质,并除去水中的异味.
点评 本题考查物质的分离、提纯的综合应用,为高考常见题型,侧重于学生的分析能力和实验能力的考查,本题注重氧化还原反应的计算,难度不大,离子的检验是高考的热点,注意离子方程式的书写.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 油脂物质分类属于酯类 | |
| B. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用Zn和稀硝酸制取H2:Zn+2H+═Zn2++H2↑ | |
| B. | H2SO4溶液中和Ba(OH)2溶液:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:2C4H3O-+CO2+H2O═2C6H5OH+CO3-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
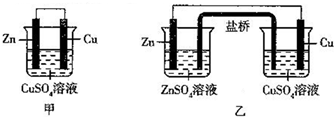
| A. | 甲是原电池、乙是电解池 | |
| B. | 铜电极上的电极反应式均为Cu2++2e-=Cu | |
| C. | 甲装置放电效率高于乙装置 | |
| D. | 当有6.5 g Zn溶解时,乙装置中会有0.2 mol电子通过盐桥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精挥发酒精燃烧 | B. | 海水“制碱”海水“晒盐” | ||
| C. | 钢铁生锈冶炼钢铁 | D. | 葡萄酿酒葡萄榨汁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲 | |
| B. | t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等 | |
| C. | 若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲 | |
| D. | 若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com