
| A.砷在通常状况下为固体 |
| B.砷的最高正化合价为+5 |
| C.砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强 |
| D.砷化氢(AsH3)不如氨气(NH3)稳定 |
科目:高中化学 来源:不详 题型:推断题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最易失去的电子能量最高 | B.电离能最小的电子能量最高 |
| C.p轨道电子能量一定高于s轨道电子能量 | D.在离核最近区域内运动电子能量最低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 丙+丁
丙+丁 丙+丁
丙+丁查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 第2周期 | | | | ⑥ | | ⑦ | | |
| 第3周期 | ① | ③ | ⑤ | | ⑧ | | ⑨ | ⑩ |
| 第4周期 | ② | ④ | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.质子数c>b | B.离子的还原性Y2->Z- |
| C.氢化物的稳定性H2Y>HZ | D.原子半径X<W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.“四中子”不显电性 |
| B.第二种粒子是氧元素的另一种同位素 |
| C.“四中子”的质量与一个4He原子质量近似相等 |
| D.第二种粒子的化学式为O4,与O2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
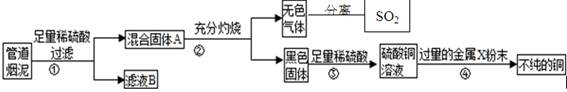

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com