
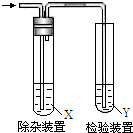
 欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )| 小组 | 乙烯的制备 | 试剂X | 试剂Y |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生消去反应生成乙烯,乙醇与Br2的CCl4溶液不反应,乙烯与Br2的CCl4溶液反应;
B.发生消去反应生成乙烯,水吸收乙醇,乙醇能被高锰酸钾氧化;
C.发生消去反应生成乙烯,NaOH溶液吸收乙醇,乙醇能被高锰酸钾氧化;
D.发生消去反应生成乙烯,乙醇与溴水不反应,但可能混有二氧化硫,二氧化硫、乙烯均与溴水发生反应.
解答 解:A.发生消去反应生成乙烯,乙醇与Br2的CCl4溶液不反应,乙烯与Br2的CCl4溶液反应,则不需要除杂,不影响乙烯检验,故A选;
B.发生消去反应生成乙烯,水吸收乙醇,乙醇能被高锰酸钾氧化,则需要加水除杂,否则干扰乙烯的检验,故B不选;
C.发生消去反应生成乙烯,NaOH溶液吸收乙醇,乙醇能被高锰酸钾氧化,则需要NaOH溶液除杂,否则干扰乙烯的检验,故C不选;
D.发生消去反应生成乙烯,乙醇与Br2的CCl4溶液不反应,但可能混有二氧化硫,二氧化硫、乙烯均与溴水发生反应,则需要除杂,否则可干扰乙烯检验,故D不选;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的结构与性质、有机物的检验及混合物分离提纯等,把握有机物的消去反应产物的检验为解答的关键,侧重分析与应用能力的考查,注意实验的评价性分析,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、NO3-、ALO2- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.
氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.| 实验编号 | 反应物 |
| a | 10mL2%H2O2溶液、少量烧碱 |
| b | 10mL2%H2O2溶液 |
| c | 10mL2%H2O2溶液、少量盐酸 |
| d | 10mL5%H2O2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
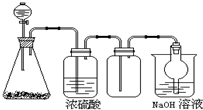 如图是一套实验室制气装置,用于发生、干燥、收集和吸收有毒气体.下列各组物质能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于发生、干燥、收集和吸收有毒气体.下列各组物质能利用这套装置进行实验的是( )| A. | MnO2和浓盐酸 | B. | Na2SO3(s)和浓H2SO4 | ||
| C. | 铁片和浓盐酸 | D. | 电石和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12属于烷烃且有三种同分异构体 | |
| B. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 | |
| C. | 苯与浓硝酸、浓硫酸混合共热制取硝酸苯是发生取代反应 | |
| D. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
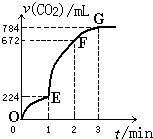 常温下,用纯净的CaCO3与100mL稀盐酸制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况).
常温下,用纯净的CaCO3与100mL稀盐酸制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com