
| A. | Fe2+ 2mol/L、Cu2+ 0.5mol/L | B. | Fe2+ 1mol/L、Fe3+ 1mol/L | ||
| C. | Fe2+ 0.5mol/L、Cu2+ 0.25mol/L | D. | Fe2+ 1.5mol/L、Cu2+ 0.5mol/L |
分析 14.35g沉淀为氯化银,其物质的量为:$\frac{14.35g}{143.5g/mol}$=0.1mol,说明每份溶液中含有0.1mol氯离子,每份溶液中氯离子的浓度为:$\frac{0.1mol}{0.02L}$=5mol/L;1.12gFe的物质的量为:$\frac{1.12g}{56g/mol}$=0.02mol,向另一只试管中加入0.02molFe后,阴离子的浓度不变,仍然为5mol/L,则阳离子的总电荷浓度一定为5mol/L,然后结合反应先后顺序对各选项进行判断.
解答 解:14.35g沉淀为氯化银,其物质的量为:$\frac{14.35g}{143.5g/mol}$=0.1mol,说明每份溶液中含有0.1mol氯离子,每份溶液中氯离子的浓度为:$\frac{0.1mol}{0.02L}$=5mol/L,
1.12gFe的物质的量为:$\frac{1.12g}{56g/mol}$=0.02mol,向另一只试管中加入0.02molFe后,阴离子的浓度不变,仍然为5mol/L,则阳离子的总电荷浓度一定为5mol/L,
A.Fe2+2mol/L、Cu2+0.5mol/L,则阳离子总电荷浓度为:2mo/L×2+0.5mol/L×2=5mol/L,满足条件,故A正确;
B.Fe2+ 1mol/L、Fe3+ 1mol/L;若反应后存在Fe3+,由于Fe3+优先与Fe反应,则溶液中的阳离子一定还存在Cu2+,故B错误;
C.Fe2+ 0.5mol/L、Cu2+ 0.25mol/L,阳离子总浓度为:0.5mol/L×2+0.25mol/L×2=1.5mol/L,不满足条件,故C错误;
D.Fe2+ 1.5mol/L、Cu2+ 0.5mol/L,阳离子总浓度为:1.5mol/L×2+0.5mol/L×2=4mol/L,不满足条件,故D错误;
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确发生反应的先后顺序为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 再加点溶质到容量瓶中去 | B. | 影响不大,不再处理 | ||
| C. | 用胶头滴管准确吸出标线上的溶液 | D. | 重新配制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从碘水中萃取碘 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从下口放出到另一个烧杯中 | |
| D. | 蒸馏操作时,收集完馏分后,先停止加热,待恢复室温后再停止通冷凝水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cu2+、Cl-、NO3- | B. | Fe2+、Na+、NO3-、Cl- | ||
| C. | K+、Na+、CO32-、SO42- | D. | K+、Na+、SO42-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
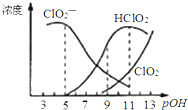 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 亚氯酸钠在碱性条件下较稳定 | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c( ClO2)>c( Cl-) | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+═2 H2O+I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com