
����Ŀ��X��Y��Z��W��ԭ��������������Ķ�����Ԫ�ء�X��Wͬ���壬Z��Wͬ���ڣ�Xԭ�Ӻ�����������Yԭ�Ӻ�����������3/4��Wԭ��������������Zԭ��������������4��������˵������ȷ����
A. ԭ�Ӱ뾶��r(X)��r(Y)��r(W)��r(Z)
B. X��Y��Z����Ԫ���γɵĻ������д������Ӽ����ۼ�
C. Ԫ��W����̬�⻯������ȶ��Ա�Ԫ��X��ǿ
D. Y��W�γɵĻ�������۵��Y��Z�γɵĻ�������۵��
���𰸡�B
��������
Wԭ��������������Zԭ��������������4����W��������Ԫ�أ��������������ܳ���8������Wԭ��������������4��Zԭ��������������1������Wλ�ڵ�IVA����Zλ�ڵ�IA����X��Wͬ���壬��Xλ�ڵ�IVA�壬Xԭ������С��W���Ҷ��Ƕ�����Ԫ�أ�����X��CԪ�ء�W��SiԪ����Z��Wͬ���ڣ���Z�ǵ�������Ԫ�أ�Wλ�ڵ�IA�壬��ZΪNaԪ�أ�Xԭ�Ӻ�����������Yԭ�Ӻ�����������![]() ��Xԭ�Ӻ���6�����ӣ���Y����8�����ӣ���YΪOԪ����
��Xԭ�Ӻ���6�����ӣ���Y����8�����ӣ���YΪOԪ����
A��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����r(Na)��r(Si)��r(C)��r(O)����r(Z)��r(w)��r(X)��r(Y)����A����B��Ԫ��X��Y��Z�ֱ�ΪC��O��Na�����߿����γɻ�����Na2CO3��Na2C2O4���������Ӽ����ۼ�����B��ȷ��C���ǽ�����X(C)��Y(O)��������⻯����ȶ���X��Y����C����D��Y(O)��W(Si)�γɵĻ�����SiO2Ϊԭ�Ӿ��壬�۷е�ܸߣ�Y(O)��Z(Na)�γɵĻ�����Ϊ���Ӿ����۵��ԭ�Ӿ���ͣ���D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���仯����㷺��������Ȼ�硣��ش��������⣺
(1)��CO2��NH3Ϊԭ�Ͽɺϳ����ء���֪
��2NH3(g)+CO2(g)=NH2COONH4(s) ��H=��159.47 kJ��mol��1
��NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ��H=+116.49 kJ��mol��1
��H2O(l)=H2O(g) ��H=+88.0 kJ��mol��1
д��NH3��CO2�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ______________________________��
(2)�����ǵ�����̼Ԫ�ص�������ճء�
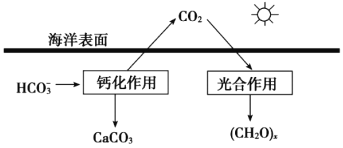
�����ں�ˮ�е�CO2��Ҫ��������̼��ʽ���ڣ�����CO2��H2CO3��___________��___________��
���ں���̼ѭ���У���ͨ����ͼ��ʾ��;����̼��д���ƻ����õ����ӷ���ʽ___________��
(3)���³�ѹ�£������е�CO2����ˮ�дﵽƽ��ʱ����ת����ϵ���£�
��CO2+H2O![]() H2CO3 K=1.8��10��3
H2CO3 K=1.8��10��3
��H2CO3![]() H++HCO3�� Ka1=4.3��10��7��
H++HCO3�� Ka1=4.3��10��7��
��HCO3��![]() H++CO32�� Ka2=5.6��10��11
H++CO32�� Ka2=5.6��10��11
ͨ������£���ˮ��pHԼΪ8��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬����Һ��c(CO2)=____________________________________________mol/L��(������λ��Ч����)
(4)Ϊ�˲���ij��ˮ����̼��������ȡ100mL��ˮ���ữ����N2����CO2������NaOH��Һ���ա���1.0mol/L����ζ�����Һ�����ɵ�V(CO2)��V(����)�仯��ϵ��ͼ1��ʾ��������Һ������Ũ���ɴ�С��˳��Ϊ__________����ˮ����̼��Ũ��Ϊ___________mol/L��
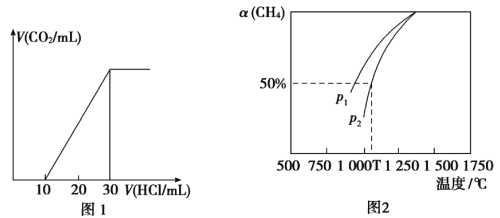
(5)��CO2����Ȼ�������Ʊ�CO��H2��CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)���ܱ�������Ũ�Ⱦ�Ϊ0.1mol/L��CH4��CO2����һ�������·�Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ����ѹǿp1___________p2(�>����<)����p2=3MPa����T��ʱ�÷�Ӧ��ƽ�ⳣ��Kp=___________MPa2(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
2CO(g)+2H2(g)���ܱ�������Ũ�Ⱦ�Ϊ0.1mol/L��CH4��CO2����һ�������·�Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ����ѹǿp1___________p2(�>����<)����p2=3MPa����T��ʱ�÷�Ӧ��ƽ�ⳣ��Kp=___________MPa2(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������X������Y��0.16 mol����10 L�����ܱ������У�������ӦX(g)+Y(g)![]() 2Z(g)����H<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
2Z(g)����H<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ����
A. ��Ӧǰ2 min��ƽ������v(Z)=2.0��10-3 mol��(L��min)-1
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv(��)>v(��)
C. ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D. �����������䣬�ٳ���0.2 mol Z��ƽ��ʱX�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���CO(g)+2H2(g) ![]() CH3OH(g)����H
CH3OH(g)����H
��1��ƽ�ⳣ������ʽΪK=_______��
��2����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�

�� �÷�Ӧ���ʱ���H________0(�����������������)��
�� T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1_______K2(�����������������)��
�� �������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���_______��
a. �����¶� b. ��CH3OH(g)����ϵ�з���
c. ʹ�ú��ʵĴ��� d. ����He��ʹ��ϵ��ѹǿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��G��Q��X��Y��Z��Ϊ���ȵĻ�������Dz��˽����ǵĻ�ѧʽ����֪��������һ�������¾������µ�ת����ϵ(δ��ƽ)����G��Q��NaCl����Q��H2O![]() X��H2����Y��NaOH��G��Q��H2O����Z��NaOH��Q��X��H2O�������ֻ���������Ԫ�صĻ��ϼ��ɵ͵��ߵ�˳��Ϊ�� ��
X��H2����Y��NaOH��G��Q��H2O����Z��NaOH��Q��X��H2O�������ֻ���������Ԫ�صĻ��ϼ��ɵ͵��ߵ�˳��Ϊ�� ��
A.GQZYXB.GYQZX
C.GYZQXD.ZXGYQ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ����
A. ��Ũ����ֱ��MnO2��KClO3��Ӧ�Ʊ�1mol������ת�Ƶĵ�������Ϊ2NA
B. ��1molCl2ͨ��ˮ�У�HClO��Cl����ClO��������֮��Ϊ2NA
C. �����£�1L pH=2��H2SO4��Һ�У������ˮ�����H+����Ϊ0.01NA
D. ���³�ѹ�£�NO2��N2O4�Ļ������46g��ԭ������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ʱHClO��Ka=3.0��10-8��HF��Ka=3.5��10-4���ֽ�pH���������ͬ�Ĵ�������������Һ�ֱ������ˮϡ�ͣ�pH����Һ����ı仯��ͼ��ʾ������������ȷ����
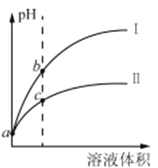
A. ����IΪ������ϡ��ʱpH�仯����
B. ȡa�����������Һ���к���ͬ�������ͬŨ�ȵ�NaOH��Һ�����Ĵ�����������С
C. a��ʱ������������ͬ��С��п������ʱ������ᷴӦ�����ʴ�
D. b����Һ��ˮ�ĵ���̶ȱ�c����Һ��ˮ�ĵ���̶�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ���ȼ���ֻ��һ�ֽṹ������֤����������������ṹ
B. ��ϩ�ͼױ�����������ԭ�Ӷ���ͬһ��ƽ����
C. һ�������£�Cl2�ڼױ��ı���������Ͼ��ܷ���ȡ����Ӧ
D. ![]() ��CH3��CH==CH2��Ϊͬ���칹��
��CH3��CH==CH2��Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ĥ����ԭ���͵绯ѧԭ���Ʊ������������ɫ������N2O5��װ����ͼ��ʾ������˵����ȷ����

A. �缫b��Ӧʽ��O2+4e��+2H2O=4OH��
B. ��װ��d�缫������Һ��pH����
C. c�缫�ϵĵ缫��ӦʽΪN2O4��2e��+H2O=N2O5+2H+
D. ÿת��2mole������2molN2O5��1molH2SO4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com