
(16分)MnO2是重要无机材料,某学习小组设计了将粗MnO2(含有较多的MnO、 MnCO3和Fe2O3,其中Fe2O3质量百分含量为10%)样品转化为纯MnO2实验,其流程如下:

(已知:氧化性强弱顺序: ClO3- > MnO2 > Fe3+)
(1)铝与二氧化锰在高温下发生铝热反应,相关反应的化学方程式为: 。
(2)第②步反应离子方程式为: 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、 、 ;
第③步蒸发得到的固体中除了含有NaClO3和NaOH外,还一定含有 (写化学式)。
(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是: 。
(5)若粗MnO2样品的质量为28.2g,第①步反应后,经过滤得到17.4g MnO2,并收集到448mL CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3才能将Mn2+完全转化为MnO2。
(1)2Al+ 3MnO2 3Mn + 2Al2O3 (3分)
3Mn + 2Al2O3 (3分)
(2)5Mn2+ + 2ClO3- +4H2O = 5 MnO2↓ + Cl2↑ + 8H+(3分)
(3)酒精灯 蒸发皿(2分,各1分)NaCl(2分)
(4)MnO2 + e- + H2O = MnO(OH) + OH- 或2MnO2 + 2e- + H2O = Mn2O3 + OH-(3分)
(5)0.04(3分)
【解析】
试题分析:(1)铝与二氧化锰在高温下发生铝热反应,产生氧化铝和锰,反应的化学方程式为:2Al+ 3MnO2 3Mn + 2Al2O3;(2)粗二氧化锰中含有MnO、 MnCO3和Fe2O3,当加入稀硫酸时,MnO、 MnCO3和Fe2O3会发生反应转化为可溶性的MnSO4、Fe2(SO4)3,将MnO2过滤除去,然后向溶液中加入稀NaClO3溶液, Mn2+被氧化为MnO2,根据电子守恒、原子守恒及电荷守恒可得第②步反应反应离子方程式为:5Mn2+ + 2ClO3- +4H2O = 5 MnO2↓ + Cl2↑ + 8H+;(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、酒精灯 蒸发皿;第③步发生的是氧化还原反应,Cl2失去电子被氧化为NaClO3,则被还原得到的是NaCl,因此蒸发得到的固体中除了含有NaClO3和过量的未反应的NaOH外,还一定含有NaCl;(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极上发生还原反应,该电极的电极反应式是MnO2 + e- + H2O = MnO(OH) + OH-;(5)n(CO2)=0.448L÷22.4L/mol=0.02mol;则根据C元素守恒可得n(MnCO3)= n(CO2)= 0.02mol;若剩余的物质完全是MnO,则其物质的量是n(MnO)=(28.2g—17.4g—0.02mol×115g/mol—28.2g×10%)÷71g/mol=0.08mol, 溶液中含有的Mn2+的物质的量是n(Mn2+)= n(MnO)+ n(MnCO3)= 0.08mol+0.02mol=0.1mol则根据方程式5Mn2+ + 2ClO3- +4H2O = 5MnO2↓ + Cl2↑ + 8H+可知消耗NaClO3的物质的量是n(NaClO3)=2/5 n(MnO)= 2/5×0.1mol=0.04mol, 即在第②步反应中至少需要0.04mol mol NaClO3才能将Mn2+完全转化为MnO2。
3Mn + 2Al2O3;(2)粗二氧化锰中含有MnO、 MnCO3和Fe2O3,当加入稀硫酸时,MnO、 MnCO3和Fe2O3会发生反应转化为可溶性的MnSO4、Fe2(SO4)3,将MnO2过滤除去,然后向溶液中加入稀NaClO3溶液, Mn2+被氧化为MnO2,根据电子守恒、原子守恒及电荷守恒可得第②步反应反应离子方程式为:5Mn2+ + 2ClO3- +4H2O = 5 MnO2↓ + Cl2↑ + 8H+;(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、酒精灯 蒸发皿;第③步发生的是氧化还原反应,Cl2失去电子被氧化为NaClO3,则被还原得到的是NaCl,因此蒸发得到的固体中除了含有NaClO3和过量的未反应的NaOH外,还一定含有NaCl;(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极上发生还原反应,该电极的电极反应式是MnO2 + e- + H2O = MnO(OH) + OH-;(5)n(CO2)=0.448L÷22.4L/mol=0.02mol;则根据C元素守恒可得n(MnCO3)= n(CO2)= 0.02mol;若剩余的物质完全是MnO,则其物质的量是n(MnO)=(28.2g—17.4g—0.02mol×115g/mol—28.2g×10%)÷71g/mol=0.08mol, 溶液中含有的Mn2+的物质的量是n(Mn2+)= n(MnO)+ n(MnCO3)= 0.08mol+0.02mol=0.1mol则根据方程式5Mn2+ + 2ClO3- +4H2O = 5MnO2↓ + Cl2↑ + 8H+可知消耗NaClO3的物质的量是n(NaClO3)=2/5 n(MnO)= 2/5×0.1mol=0.04mol, 即在第②步反应中至少需要0.04mol mol NaClO3才能将Mn2+完全转化为MnO2。
考点:考查化学反应方程式和离子方程式的书写、混合物分离方法的操作方法及仪器的使用、原电池电极反应式的书写、关于化学反应方程式的计算的知识。


科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
三氟化硼二甲醚配合物是一种有机催化剂。下列相关构成微粒的表示不正确的是
A.二甲醚的结构简式:C2H6O
B.中子数为5的硼原子:
C.氟原子结构示意图:
D.三氟化硼的电子式:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:选择题
室温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=12的溶液中:AlO2-、Na+、SO 4 2-、SO32-
B.水电离出的c(H+)=10-12mol/L的溶液中:K+、Na+、SO 4 2-、AlO2-
C.能与铝反应生成氢气的溶液中:Mg2+、Na+、Cl-、NO3-
D.c(H+)=0.10mol/L的溶液中:CH3COO-、NH4+、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省深圳市高三第一次调研考试理综化学试卷(解析版) 题型:选择题
(16分)工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:

(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)充分焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 ,90℃时Ksp(Li2CO3)的值为 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省深圳市高三第一次调研考试理综化学试卷(解析版) 题型:选择题
下列离子方程式错误的是
A.石灰石和盐酸反应制CO2:CaCO3 + 2H+ = CO2↑+ Ca2+ +H2O
B.稀Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-= 3Fe3++NO↑+2H2O
C.Ca(ClO)2 溶液中通入过量的SO2:C1O-+ SO2 + H2O = HClO + HSO3-
D.铜溶于FeCl3溶液中:Cu + 2Fe3+ =2 Fe2+ + Cu2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三学业水平考试理综化学试卷(解析版) 题型:选择题
常温下,对于pH = 11的NaOH溶液,下列说法错误的是
A.c(OH-) =c(Na+) + c(H+)
B.该溶液中的c(OH-) = 1.0×10-3 mol·L-1
C.与等体积pH = 3的醋酸混合后所得溶液显碱性
D.与等体积0.001 mol·L-1的氯化铵混合后所得溶液中:c(Na+)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市昌平区高二上学期期末考试化学试卷(解析版) 题型:推断题
(9分)叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
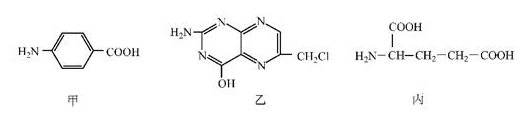
(1)甲中显酸性的官能团是 (填名称)。
(2)下列关于乙的说法,正确的是 (填名称)。
a.分子中碳原子和氮原子的个数比是7∶5
b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应
d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为 。
a.含有H2N-CH-COOH
b.在稀硫酸中水解有乙酸生成
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):

①步骤Ⅰ的反应类型是 。
②步骤Ⅰ和Ⅳ在合成甲过程中的目的是 。
③步骤反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省绵阳市高一上学期期末化学试卷(解析版) 题型:填空题
实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)实验室只有100 mL、250 mL、500 mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需取该浓硫酸 mL。
(2)接下来完成此实验你将用到的仪器有20 mL量筒、烧杯、玻璃棒、____________。
(3)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是________________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(4)下列操作会使所配溶液浓度偏低的是 。
A.用量筒量取浓硫酸,读数时仰视刻度线
B.转移溶液时未洗涤烧杯
C.容量瓶用蒸馏水洗净后仍残留有蒸馏水
D.定容时俯视容量瓶的刻度线
E.定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com