
| A. | 0.4mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.05mol/L |
分析 根据n=cV分别计算出两溶液中氢离子、氢氧根离子的物质的量,然后根据中和反应实质计算出混合液中氢氧根离子的物质的量,最后根据c=$\frac{n}{V}$计算出混合液中OH-离子物质的量浓度.
解答 解:100mL 0.6mol/L的盐酸中含有氢离子的物质的量为:0.6mol/L×0.1L=0.06mol,
100mL 0.4mol/L的Ba(OH)2溶液中含有氢氧根离子的物质的量为:0.4mol/L×2×0.1L=0.08mol,
则混合液中氢氧根离子的物质的量为:0.08mol-0.06mol=0.02mol,
所以混合液中氢氧根离子的物质的量浓度为:$\frac{0.02mol}{0.1L+0.1L}$=0.1mol/L,
故选C.
点评 本题考查了物质的量浓度、酸碱中和反应的计算,题目难度中等,明确发生反应的实质及物质的量浓度的表达式为解答关键,试题充分考查了学生的分析能力及化学计算能力.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2溶于水成为硅酸 | |
| B. | CO2通入水玻璃中得到白色沉淀 | |
| C. | CO2通入饱和CaCl2溶液能生成白色沉淀 | |
| D. | 硅酸酸性比碳酸弱,所以SiO2不能跟Na2CO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
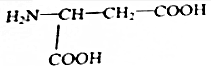 (5)
(5)
| A. | 二肽 | B. | 三肽 | C. | 四肽 | D. | 五肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有6.02×1023个微粒 | |
| B. | 硫酸的摩尔质量是98g | |
| C. | 等质量的SO2和SO3中所含的硫原子数相等 | |
| D. | 等质量的O2和O3中所含的氧原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠起催化作用 | B. | 氢氧化钠使温度升高 | ||
| C. | 氢氧化钠作用掉氢氧化铝 | D. | 氢氧化钠作用掉氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液:NH4+、OH-、Na+、HCO3- | |
| B. | 0.1mol/LNaNO3溶液:H+、Fe2+、Cl_、SO42- | |
| C. | 与Al反应能产生大量H2溶液:CO32-、K+、Na+、NH4+ | |
| D. | 水溶液:OH-、S2-、Na+、CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com