
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
分析 (1)硫代硫酸根离子和氢离子反应生成硫、二氧化硫和水;
(2)当分析某一因素对化学反应速率的影响时,其它物理量要相同;
(3)根据二氧化硫的性质或实验装置分析不利因素.
解答 解:(1)硫代硫酸根离子和氢离子反应生成硫、二氧化硫和水,离子反应方程式为:S2O32-+2H+═S↓+SO2↑+H2O,
故答案为:S2O32-+2H+═S↓+SO2↑+H2O;
(2)①能说明温度对该反应速率影响的组合中两者的温度不同,其它物理量相同,故选BD,故答案为:BD;
②A和B、A和C的组合中不同的物理量是浓度,所以比较所研究的问题是相同温度条件下浓度对该反应速率的影响,
故答案为:相同温度条件下浓度对该反应速率的影响;
(3)二氧化硫可以溶于水,1体积水能溶解40体积二氧化硫,所以导致测定不精确,且该实验装置较复杂,不易控制,所以不采用排水法测量单位时间内气体体积的大小进行比较,故答案为:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
点评 本题考查探究影响化学反应速率的因素,做对比实验时,只有改变一个条件,其它物理量相同才能得出正确结论,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:填空题
(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 = —702 kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 = —182 kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3=  。
。
(3)已知 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:

①图中A、C分别表示 、 ,
②E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
③图中△H= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:填空题
室温下将6g CH3COOH溶于水配制成1L的溶液,此溶液的物质的量浓度为 ,经测定溶液中c(CH3COO-)浓度为1.4×10-3mol/L,此温度下醋酸的电离平衡常数K= ,此时溶液中由水电离出的c(H+)与c(OH-)之积 (填“大于”、“小于”或“等于”)1. 0×l0?14。温度升高,K将 (填“变大”或“变小”或“不变”),醋酸的电离平衡向_____________移动(填“左”或“右”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
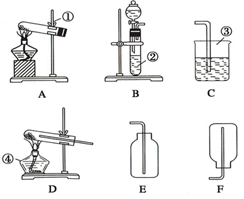 现有A,B,C,D,E,F六种装置,如图所示.(胶塞,导管可自由选用)
现有A,B,C,D,E,F六种装置,如图所示.(胶塞,导管可自由选用)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
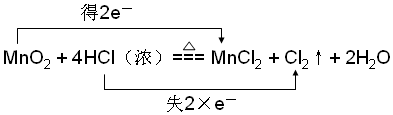 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2的燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 稀硫酸和Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NH4HCO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
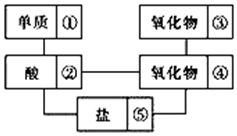 在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①-⑤中适当的物质,使有连线的两种物质能发生反应.
在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①-⑤中适当的物质,使有连线的两种物质能发生反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com