
| A. | 22.4LCO中一定含有6.02×1023个分子 | |
| B. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| C. | 常温常压下,16gO2与16gO3含有的分了数相同 | |
| D. | 0.1mol/LK2SO4溶液中含有K+为0.2NA |
分析 A、CO所处的状态不明确;
B、分别求出甲烷和水的物质的量,然后根据甲烷和水均为10电子分子来分析;
C、氧气和臭氧的摩尔质量不同;
D、溶液体积不明确.
解答 解:A、CO所处的状态不明确,故22.4LCO的物质的量无法计算,则含有的分子个数无法计算,故A错误;
B、标况下22.4L甲烷的物质的量为1mol,18g水的物质的量也为1mol,而甲烷和水均为10电子分子,故1mol甲烷和1mol水中含有的电子个数均为10NA个,故B正确;
C、氧气和臭氧的摩尔质量分别为32g/mol和48g/mol,故16g氧气和16g臭氧的物质的量之比为48:32=3:2,则分子个数之比也为3:2,故C错误;
D、溶液体积不明确,故溶液中的钾离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa混合液,溶液显酸性,则溶液中粒子浓度:c(CH3COOH)>c(CH3COO-)>c (Na+)>c(H+)>c(OH-) | |
| B. | 浓度均为0.1 mol•L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)═2c(H+)+c(HA) | |
| D. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)═c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得电子越多,其氧化性越强 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 要完成SO32-→SO42-的转化,必须加入氧化剂 | |
| D. | 金属活动顺序表中,排在前面的金属阳离子的氧化性强于排在后面的金属阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 稀释前,c (A)>10 c (B) | |
| B. | 稀释前,A溶液中水电离出的OH- 浓度是B溶液中由水电离出的OH- 浓度的10倍 | |
| C. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| D. | M点时A和B的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 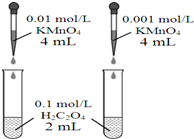 依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 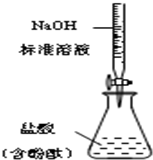 测定盐酸浓度 | |
| C. | 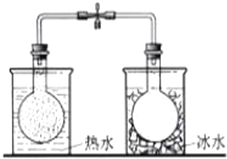 依据气体颜色变化,证明温度对平衡移动的影响 | |
| D. | 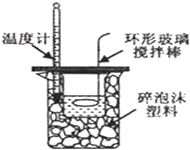 中和热的测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com