
| A、1:1 | B、1:3 |
| C、3:1 | D、3:2 |
| 1 |
| 3 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
| A、氢氧化铜和稀盐酸反应 |
| B、氢氧化钡溶液滴入稀硫酸中 |
| C、氢氧化钠溶液与硝酸反应 |
| D、醋酸和氢氧化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl溶液在电流的作用下电离出Na+ |
| B、离子化合物一定是电解质 |
| C、氨水呈弱碱性,故NH3是弱电解质 |
| D、溶于水电离出氢离子的化合物都是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
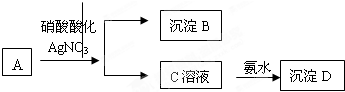
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑦ | B、③⑤ |
| C、②③⑥ | D、④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转 |
| B、能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动 |
| C、能层序数越大,s原子轨道的半径越大 |
| D、某微粒的最外层电子排布为2s22p6,则该微粒为Ne |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com