
 Na2CO3+H2O+CO2↑,产生的二氧化碳通入足量的Ca(OH)2饱和溶液中,发生反应CO2+Ca(OH)2═CaCO3↓+H2O,充分反应后得到的沉淀的质量为10.0g为碳酸钙,根据n=
Na2CO3+H2O+CO2↑,产生的二氧化碳通入足量的Ca(OH)2饱和溶液中,发生反应CO2+Ca(OH)2═CaCO3↓+H2O,充分反应后得到的沉淀的质量为10.0g为碳酸钙,根据n= 计算碳酸钙的物质的量,进而计算加入生成二氧化碳的物质的量,据此计算NaHCO3的物质的量,再根据m=nM计算原固体化合物中NaHCO3的质量;
计算碳酸钙的物质的量,进而计算加入生成二氧化碳的物质的量,据此计算NaHCO3的物质的量,再根据m=nM计算原固体化合物中NaHCO3的质量; 计算该反应生成的二氧化碳的物质的量,进而计算加热后剩余的固体中Na2CO3的物质的量,减去NaHCO3分解生成的Na2CO3的物质的量即为原混合固体中含有的Na2CO3,再根据m=nM计算原混合固体中Na2CO3的质量.
计算该反应生成的二氧化碳的物质的量,进而计算加热后剩余的固体中Na2CO3的物质的量,减去NaHCO3分解生成的Na2CO3的物质的量即为原混合固体中含有的Na2CO3,再根据m=nM计算原混合固体中Na2CO3的质量.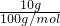 =0.1mol,故加热碳酸氢钠生成的二氧化碳为0.1mol,
=0.1mol,故加热碳酸氢钠生成的二氧化碳为0.1mol, Na2CO3+H2O+CO2↑可知,原混合固体中NaHCO3的物质的量为0.1mol×2=0.2mol,
Na2CO3+H2O+CO2↑可知,原混合固体中NaHCO3的物质的量为0.1mol×2=0.2mol,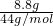 =0.2mol,由方程式可知加热后剩余的固体中Na2CO3的物质的量为0.2mol,故原混合固体中Na2CO3的物质的量为0.2mol-0.1mol=0.1mo,故原混合固体中Na2CO3的质量为0.1mol×106g/mol=10.6g,
=0.2mol,由方程式可知加热后剩余的固体中Na2CO3的物质的量为0.2mol,故原混合固体中Na2CO3的物质的量为0.2mol-0.1mol=0.1mo,故原混合固体中Na2CO3的质量为0.1mol×106g/mol=10.6g,

 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的Na2CO3和NaHCO3混合物加热灼烧至恒重,放出的气体通入足量的
Ca(OH)2饱和溶液中,充分反应后得到的沉淀的质量为1.0 g。加热后剩余的固体物质与足量盐酸反应,收集到0.05 mol气体。计算原混合物中Na2CO3与NaHCO3的物质的量之比。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com