
 铝是现今人类生产生活中使用广泛性仅次于铁的重要金属.工业上常以“钒土矿”为原料来冶炼金属铝.已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质).为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
铝是现今人类生产生活中使用广泛性仅次于铁的重要金属.工业上常以“钒土矿”为原料来冶炼金属铝.已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质).为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:分析 钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质),用过量稀盐酸溶解得AlCl3、FeCl3、HCl溶液,以及不溶残渣SiO2,向滤液中加氢氧化钠溶液,氢氧化钠先与盐酸反应,盐酸被完全中和后,AlCl3、FeCl3与氢氧化钠反应生成Al(OH)3、Fe(OH)3,再加氢氧化钠溶液,Al(OH)3溶解,Al(OH)3与氢氧化钠反应生成偏铝酸钠,最后所得不溶于NaOH溶液的沉淀为Fe(OH)3,根据图象中用去的氢氧化钠溶液的体积进行计算,结合电解原理分析答题.
解答 解:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质),用过量稀盐酸溶解得AlCl3、FeCl3、HCl溶液,以及不溶残渣SiO2,向滤液中加氢氧化钠溶液,氢氧化钠先与盐酸反应,盐酸被完全中和后,AlCl3、FeCl3与氢氧化钠反应生成Al(OH)3、Fe(OH)3,再加氢氧化钠溶液,Al(OH)3溶解,Al(OH)3与氢氧化钠反应生成偏铝酸钠,最后所得不溶于NaOH溶液的沉淀为Fe(OH)3,
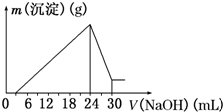
(1)滴加NaOH溶液0~3mL时,盐酸与氢氧化钠发生中和反应,反应的离子方程式为H++OH-=H2O,
故答案为:H++OH-=H2O;
(2)25.0mL样品溶液中,根据上面的分析可知,最后所得不溶于NaOH溶液的沉淀的化学式为 Fe(OH)3,根据图象可知Al(OH)3~NaOH~NaAlO2,用于溶解氢氧化铝的氢氧化钠溶液的体积为6mL,所以生成氢氧化铝用去的氢氧化钠溶液的体积为18mL,滴加NaOH溶液0~3mL时,氢氧化钠与盐酸反应,所以与铁离子反应生成氢氧化铁用去的氢氧化钠溶液的体积为24mL-3mL-18mL=3mL,根据Fe(OH)3~3NaOH,Fe(OH)3物质的量为$\frac{2.5mol•{L}^{-1}×3mL}{3}$=2.5×10-3mol,
故答案为:Fe(OH)3;2.5×10-3mol;
(3)25.0mL样品溶液中,根据图象可知Al(OH)3~NaOH~NaAlO2,用于溶解氢氧化铝的氢氧化钠溶液的体积为6mL,则n(Al)=6×10-3L×2.5mol•L-1=0.015mol,所以该钒土矿样中Al2O3的质量分数为$\frac{\frac{0.015mol}{2}×102g/mol×\frac{250mL}{25mL}}{10.0g}$×100%=76.5%,
故答案为:76.5%;
(4)电解Al2O3,阳极上氧离子失去电子得氧气,阴极上铝离子得电子生成铝,根据铝元素守恒可知,10.0t“钒土矿”最多可制得金属铝的质量为$10.0t×76.5%×\frac{54}{102}$=4.05t,
故答案为:阴;4.05t.
点评 本题为生产工艺流程题,涉及电解、计算等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,本题难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,NaHCO3溶液的pH值比同浓度的CH3COONa溶液小 | |
| B. | 常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均降低 | |
| C. | 把FeCl3和FeCl2溶液分别蒸干并灼烧最后都得到Fe2O3 固体 | |
| D. | 以酚酞作指示剂,用相同浓度的盐酸滴定等体积等浓度的NaOH溶液和氨水,消耗盐酸的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z 元素的气态氢化物的热稳定性均依次递减 | |
| B. | Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | 液态WX3 气化均需克服分子间作用力 | |
| D. | 根据元素周期律,可以推测T 元素的单质具有半导体的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示为中学化学实验中几种常见仪器的部分结构:
如图所示为中学化学实验中几种常见仪器的部分结构:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| C. | 氢氧化铁胶体的电泳实验能证明氢氧化铁胶体带正电 | |
| D. | 在体积相同的两个密闭容器中分别充满O2和O3气体,当这两个容器内温度和气体密度相等时,两种气体的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | c | D | |
| 用 品 |  |  |  |  |
| 主要成分 | CO2 | Fe2O3 | NaHCO3 | C12H22011 |
| 用途 | 做制冷剂 | 做红色涂料 | 除油污 | 做调味剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com