下列说法正确的是( )
①向50mL 18mo1?L-1的H2SO4中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
②标准状况下,0.5NA个NO和0.5NA个O2混合气体的体积约为22.4L
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤在使Al溶解产生H2的溶液中能大量存在:NH4+、Na+、Fe2+、NO3-.
A.仅②⑤
B.仅①③⑤
C.仅④
D.仅③④
【答案】
分析:①根据浓硫酸与铜反应,随着反应的进行,浓硫酸变稀,稀硫酸与铜不反应;
②根据NO和O
2反应生成NO
2;
③根据加入氯化钡可能生成AgCl沉淀;
④根据丁达尔现象可以区分溶液和胶体;
⑤根据加入Al能放出H
2的溶液可能为酸或碱的溶液;
解答:解:①Cu+2H
2SO
4(浓)
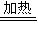
CuSO
4+SO
2↑+2H
2O,被还原的硫酸的物质的量理论上应是参加反应的硫酸的一半,但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半,
则50mL 18mol/LH
2SO
4溶液中加入足量的铜片并加热后被还原的硫酸的物质的量应为小于0.45mol,故①错误;
②NO和O
2反应生成NO
2:2NO+O
2=2NO
2,混合气体的物质的量小于1mol,体积约为小于22.4L,故②错误;
③加入氯化钡可能生成AgCl沉淀,不能说明溶液中一定含有SO
42-,应先加盐酸,如无现象,再加氯化钡检验,故③错误;
④食盐水为溶液,淀粉溶液为胶体,根据丁达尔现象可以区分食盐水和淀粉溶液,故④正确;
⑤因加入Al能放出H
2的溶液可能为酸或碱的溶液,若在碱溶液中,OH
-离子与Fe
2+结合生成沉淀,OH
-离子与NH
4+结合生成若电解质,若在酸溶液中,Fe
2+、NO
3-发生氧化还原反应,即该组离子一定不能大量共存,故⑤错误;
故选:C;
点评:本题考查较为综合,涉及物质的性质,检验和鉴别,解答本题的关键是能正确把握相关物质的性质,学习中注意积累相关知识.

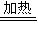 CuSO4+SO2↑+2H2O,被还原的硫酸的物质的量理论上应是参加反应的硫酸的一半,但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半,
CuSO4+SO2↑+2H2O,被还原的硫酸的物质的量理论上应是参加反应的硫酸的一半,但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半,


 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,