


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
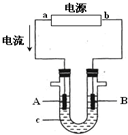 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下查看答案和解析>>
科目:高中化学 来源: 题型:
 如图1为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图1为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
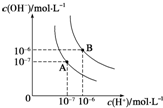 (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应物总能量低于生成物总能量时,该反应不能发生 |
| B、稀的强酸与稀的强碱反应放出的热量就是中和热 |
| C、由C(石墨)(s)→C(金刚石)(s);△H>0可行,石墨比金刚石稳定 |
| D、在101kPa,25℃时,2gH2完全燃烧生成液态水,放出285.8kJ的热量;氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(1);△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤⑧⑨ | B、⑥⑧⑨ |
| C、③⑤⑨ | D、③⑤⑥⑦⑧⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com