
分析右面的能量变化示意图,确定下列选项中正确的是
A.2A(g)+B(g)===2C(g) ΔH<0
B.2A(g)+B(g)===2C(g) ΔH>0
C.2A+B===2C ΔH<0
D.2C===2A+B ΔH<0

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
水能与多种金属离子形成络合物,某红紫色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成, 且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为( )
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ Co(NH3)5(H2O)]Cl3
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ CoCl(NH3)5]Cl2·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐和工业用盐具有广泛的用途。已知工业用盐主要成分为NaNO2,外观酷似食盐并有咸味。NaNO2有氧化性和还原性,遇酸分解放出NO2。
(1)下列试剂可鉴别工业用盐和食盐的是________。
a.H2O b.硝酸酸化的硝酸银
c.盐酸
(2)NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为______________。
(3)某工厂废液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2中的氮转化为对空气无污染的气体,该物质是________。
a.NaCl b.NH4Cl c.浓H2SO4
(4)氯碱工业通过电解饱和食盐水来获得相应的产物。请写出电解食盐水的离子方程式______________________________________,
若在标准状况下生成3.36 L H2,则溶液中生成的OH-的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于铜电极的叙述,不正确的是 ( )
A.铜锌原电池中铜是正极 B.用电解法精炼粗铜时,粗铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极 D.电解稀硫酸制H2、O2时,铜作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.
(1)D在周期表中的位置 ;B的原子核外电子排布示意图 ;
(2)E元素形成最高价氧化物对应水化物对应的水化物的化学式为 ;
(3)元素C、D、E形成的原子半径大小关系是 (用元素符号表示)。
(4)C、D可形成化合物D2C2,D2C2含有的化学键是 ;
(5)A、C两种元素形成的原子个数之比为1:1的化合物电子式 ,
(6)B的氢化物与B的最高价氧化物的水化物反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味的气体放出。符合这一情况的是下表中的
| a极板 | b极板 | x电极 | z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1 B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
综合利用转炉煤气[CO(60~80%)、CO2(15~20%)及微量N2等]和硫酸工业尾气中的SO2,既能净化尾气,又能获得保险粉(Na2S2O4),其部分工艺流程如下:
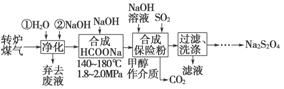
(1)转炉炼钢时,存在反应:Fe3C(s)+CO2(g)2CO(g)+3Fe(s),其平衡常数表达式为K=________。
(2)煤气净化时,先用水洗再用NaOH溶液洗涤,其目的是________。
(3)从滤液中回收甲醇的操作方法是____________________________;
还可回收的盐类物质是______________________________________(只写一种化学式)。
(4)合成保险粉反应的化学方程式为_________________________。
(5)保险粉、H2O2均可用于纸浆漂白,写出保险粉与过量的H2O2,在水溶液中反应生成硫酸盐等物质的离子方程式:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com