
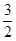 O2(g);△H="+765.2" kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
O2(g);△H="+765.2" kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。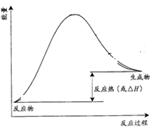 (2分);
(2分); Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质。(2分)
Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质。(2分) Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质,所以明矾可以作为净水剂。
Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质,所以明矾可以作为净水剂。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
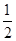 O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,
O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,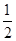 O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
O2(g) ="==" CO(g) ΔH=-110.5kJ·mol-1,
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1 = Q2 = Q3 | B.2Q3 = Q1 < Q2、 |
| C.Q3 < Q2 < Q1 | D.Q2< Q1< Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.煤、石油、天然气等是化石燃料 |
| B.氢氧化钡晶体与氯化铵晶体的反应是放热反应 |
| C.直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好 |
| D.酸与碱发生中和反应时放出的热量叫中和热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲烷在氧气中的燃烧反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与二氧化碳的反应 | D.铝与稀盐酸的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
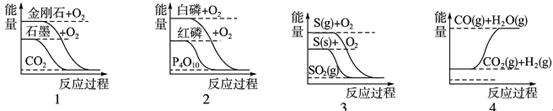
| A.石墨转变为金刚石是吸热反应 |
| B.白磷比红磷稳定 |
| C.S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)===SO2(g) ΔH2则ΔH1>ΔH2 |
| D.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH1>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.需要加热才能发生的反应一定是吸热反应; |
| B.放热反应在常温下一定很容易发生; |
| C.反应是放热或吸热,必须看反应物和生成物所具有的总能量的相对大小; |
| D.分子中键能越大则分子能量越高,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在相同条件下:2C(石墨) + O2(g) = 2CO(g) ΔH =" -" 110.5 kJ·mol-1 |
| B.1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ |
| C.在相同条件下:C(石墨) + CO2(g) = 2CO(g) ΔH =" -" 172.5 kJ·mol-1 |
| D.已知金刚石燃烧热大于石墨的燃烧热,则石墨转变为金刚石需要吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com