
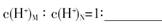
 Al(OH)3 + OH-;
Al(OH)3 + OH-;  Al(OH)3 + OH-; (5)O和Na按原子个数比1:1形成一种离子化合物过氧化钠,根据题给信息写出过氧化钠与水反应的热化学反应方程式为
Al(OH)3 + OH-; (5)O和Na按原子个数比1:1形成一种离子化合物过氧化钠,根据题给信息写出过氧化钠与水反应的热化学反应方程式为

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.所有原子都是由质子、中子和核外电子构成的 |
| B.只要知道粒子的质子数,就一定能确定它是什么元素 |
| C.由于质量数=质子数+中子数,所以,电子是没有质量的 |
| D.分子的质子数等于该分子中各原子质子数之和 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原子半径:Z<W<R |
| B.金属性:X>Z |
| C.氢氧化物的碱性:Z>W>R |
| D.最外层电子数:X>Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若它能形成①时,则不可能形成②,③ |
| B.若它能形成②时,则还可以形成③,④ |
| C.若它能形成①时,则不可能形成④ |
| D.若它能形成②时,则可以形成① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.最高价氧化物对应水化物的酸性:H3PO4>H2SO4>HNO3 |
| B.与冷水的反应速率:K>Na>Mg |
| C.热稳定性:HF>HCl>H2S |
| D.离子半径:Cl->F->Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
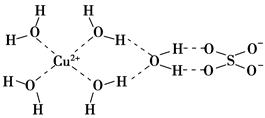
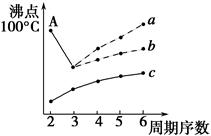
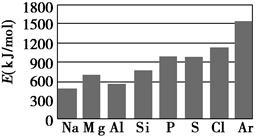
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com