
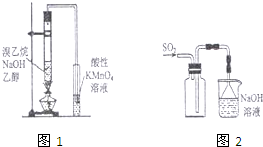
 下列有关实验原理或操作正确的是
下列有关实验原理或操作正确的是

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:阅读理解
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)对于可逆反应mA(g)+nB(g) ![]() pC(g)+qD(g)达平衡时,V正=k1c(A)mc(B)n(K1为速率常数),达平衡时化学平衡常数为K2,且K1、K2只与温度有关。现将4molSO2与2molO2充入体积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达到平衡时,SO2的转化率为50%。则起始时正反应速率是平衡时的 倍。500℃时,该反应的平衡常数K2是 。在温度不变时,再向平衡体系中加人2molSO2、2molO2与4molSO3,平衡将向 移动。
pC(g)+qD(g)达平衡时,V正=k1c(A)mc(B)n(K1为速率常数),达平衡时化学平衡常数为K2,且K1、K2只与温度有关。现将4molSO2与2molO2充入体积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达到平衡时,SO2的转化率为50%。则起始时正反应速率是平衡时的 倍。500℃时,该反应的平衡常数K2是 。在温度不变时,再向平衡体系中加人2molSO2、2molO2与4molSO3,平衡将向 移动。
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。
设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”,“>”)。

(3)难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(KSP)。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。已知常温下Cu(OH)2的溶度积为2×10![]() ,若某CuSO4溶液里,c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于 ;要使0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为 。
,若某CuSO4溶液里,c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于 ;要使0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为 。
(4)常温下,某纯碱(Na2CO4)溶液中滴入酚酞,溶液呈红色。则该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO![]() 水解所至。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
水解所至。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com