
【题目】将蔗糖水解,并用新制的氢氧化铜悬浊液检验其水解产物的实验中,要进行的主要操作是( )
①加热
②滴入稀硫酸
③加入新制的氢氧化铜悬浊液
④加入适量的氢氧化钠溶液调节至碱性
A.②→①→④→③→① B.①→②→③→④→①
C.②→④→①→③→① D.③→④→①→②→①
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】铝是一种很重要的金属,可以发生一系列反应制备物质。

回答下列问题:
(1)反应①可以用于 (说出一条)。
(2)②③反应产生等量氢气消耗的NaOH与H2SO4的物质的量之比为 。
(3)反应④的离子反应的方程式为 。
(4) 用反应⑥制备Al(OH)3,最好是向Al2(SO4)3溶液中滴加 。
(5)工业上常用反应⑦制备金属铝,制备过程的方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
![]() +2FeCl3
+2FeCl3![]()
![]() +2FeCl2+2HCl
+2FeCl2+2HCl
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程:加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥

请回答下列问题:
(1)写出装置图中玻璃仪器的名称:a ,b ;
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:
A.缓慢冷却溶液
B.溶液浓度较高
C.溶质溶解度较小
D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用 等方法(选填一种)促进晶体析出;
(3)抽滤所用的滤纸应略 (填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是 ;
A.无水乙醇 B.饱和NaCl溶液 C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质: ;
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是 。

A.15min B.30min
C.45min D.60min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】截止到2013年12月末,中国光伏发电新增装机容量达到10.66GW,光伏发电累计装机容量达到17.16GW,图为光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是

A. N型半导体为正极,P型半导体为负极
B. 制氢装置溶液中电子流向:从B极流向A极
C. X2为氧气
D. 工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约为1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
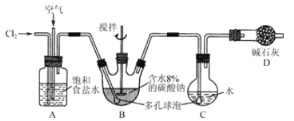
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)① 实验中控制氯气与空气的体积比的方法是 。
② 为使反应充分进行实验中采取的措施有 。
(2)① 装置B中产生Cl2O的化学方程式为 。
② 若B无冷却装置,进入C中的Cl2O会大量减少。其原因是 。
(3)装置C中采用棕色圆底烧瓶是因为 。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案为:用 量取20.00 mL次氯酸溶液, 。
(可选用的试剂有H2O2溶液、FeCl2溶液、AgNO3溶液。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 现代元素周期表中,元素按照元素的相对原子质量递增顺序排列
B. 第ⅠA族元素的金属性比第ⅡA族元素的金属性强
C. 在元素周期表中金属与非金属的分界线附近,可以找到半导体材料
D. 室温时,第IA族元素的单质都是固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,有关该有机物的叙述不正确的是

A. 在一定条件下,能发生取代、氧化、酯化和加聚反应
B. 该物质分子中最多可以有11个碳原子在同一平面上
C. 1mol该物质最多可与4molH2发生加成反应
D. 1mol该物质完全氧化最多可消耗14mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
(1)已知:CO燃烧热△H2=-283kJ·mol-1。几种化学键键能数据如下:
化学键 | N=N键 | O=O键 |
|
键能/kJ·mol-1 | 945 | 498 | 630 |
N2(g)+O2(g)=2NO(g) △H3= ,上述△H1= 。
(2)CO——空气在KOH溶液中构成燃料电池(石墨为电极),若放电后,电解质溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),则负极的电极反应式为 。
(3)2CO(g)+2NO(g)![]() N2(g)+2CO2(g)的平衡常数表达式为 。图A中曲线 (填“I”或“II”)能正确表示平衡常数与温度的关系,理由是 。
N2(g)+2CO2(g)的平衡常数表达式为 。图A中曲线 (填“I”或“II”)能正确表示平衡常数与温度的关系,理由是 。

(4)当NO、CO的浓度比为1时,体系中NO平衡转化率(α)与温度、压强的关系如图B所示。α(NO)随着温度升高而 (填“增大”或“减小”),其原因是 。图B中,压强由小到大的顺序为 ,其判断理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com