
有机物A完全燃烧只生成CO2和H2O,将12 g该有机物完全燃烧的产物通过足量浓硫酸,浓硫酸增重14.4 g,再通过足量碱石灰,碱石灰增重26.4 g,该有机物的分子式是( )
A.C4H10 B.C2H6O
C.C3H8O D.C2H4O2
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
某烷烃相对分子质量为86,跟Cl2反应生成一氯取代物只有两种,它的结构简式、名称全正确的是( )
A.CH3(CH2)4CH3 己烷
B.(CH3)2CHCH(CH3)2 2,3-二甲基丁烷
C.(C2H5)2CHCH3 2-乙基丁烷
D.C2H5C(CH3)3 2,2-二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式对应的化学方程式正确的是
A.H++OH-=H2O CH3COOH+NaOH=CH3COONa+H2O
B.Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO4↓+2H2O
C.CO32-+2H+=CO2↑+H2O CaCO3+2HCl=CaCl2+CO2↑+H2O
D.3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
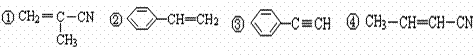 有5种有机物:
有5种有机物:
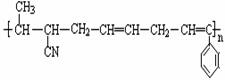
⑤CH2=CH—CH=CH2 ,
其中可用于合成高分子材料
(结构如右图所示)的正确组合为:( )
A.①②④ B.①②⑤ C.②④⑤ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
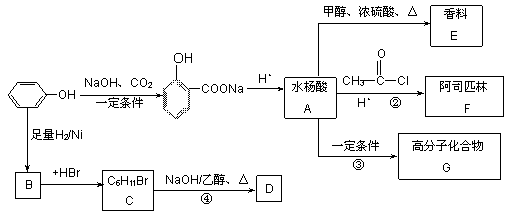
 苯酚是一种重要的化工原料,以下是以苯酚为原料,生产阿司匹林、香料和高分子化合物的合成线路图。
苯酚是一种重要的化工原料,以下是以苯酚为原料,生产阿司匹林、香料和高分子化合物的合成线路图。
 (3)R—OH+HBr
(3)R—OH+HBr R—Br+H2O
R—Br+H2O
(1)写出反应类型:反应④属于_____________反应,反应③属于________________反应。
(2)写出下列有机物的结构简式:E___________、G_____________、F____________。
(3)可以检验阿司匹林样品中含有水杨酸的试剂是__________(填写字母)。
A.碳酸氢钠溶液 B.氯化铁溶液 C.红色石蕊试液 D.新制氢氧化铜悬浊液
(4)与阿司匹林互为同分异构体的物质有多种,请按以下要求写出阿司匹林的一种同分异构体:①苯环上有两个对位的取代基;②能发生银镜反应;③含有酯基和羧基的有机物________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
验证某有机物属于烃,应完成的实验内容是( )
A.只测定它的C、H比
B.只要证明它完全燃烧后产物只有H2O和CO2
C.只测定其燃烧产物中H2O与CO2的物质的量的比值
D.测定该试样的质量及试样完全燃烧后生成CO2和H2O的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.17g羟基(-OH)所含有的电子数是10 NA个
B.1mol苯乙烯中含有的碳、碳双键数为4NA个
C.常温下,14g乙烯和丙烯的混合物中总原子数为3NA个
D.4.2g C3H6中含有的碳碳双键数一定为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
1,2 -二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2 -二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。

填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式。_ ; 。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:____________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因: _____, _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:


⑴反应②是 (填“吸热”或“放热”)反应。
 ⑵某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
⑵某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
⑶在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
⑷甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼雷电池,其原理如图所示。该电池的负极反应式是 。
⑸一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com