
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数( | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
| c(CH3COO-) |
| c(CH3COOH) |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| c(CH3COO-) |
| c(CH3COOH) |
| 1.8×10-5 |
| 10-6 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
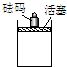 在一定条件下,向如图容器中加入一定量的A和B,发生反应:mA+nB?pC达到平衡.
在一定条件下,向如图容器中加入一定量的A和B,发生反应:mA+nB?pC达到平衡.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊是易导电的银白色金属 |
| B、能生成+3价离子 |
| C、氢氧化铊是两性氢氧化物 |
| D、Tl3+的氧化能力比Al3+强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
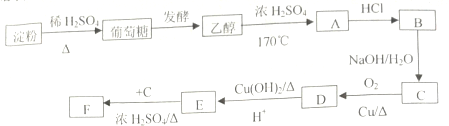
| 发酵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
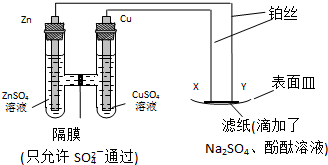
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com