
ЁОЬтФПЁПИљОнЮЪЬтЬюПеЃК
ЃЈ1ЃЉШчЭМЪЧМИжжЭщЬўЕФЧђФЃаЭЃЌЪдЛиД№ЮЪЬтЃК 
ЂйЕШжЪСПЕФAЁЂBЁЂCгызуСПбѕЦјЗДгІЃЌЯћКФбѕЦјЕФСПзюЩйЕФЪЧ ЃЎ
ЂкBЕФЖўТШДњЮягажжЃЎ
ЂлФГжжЯЉЬўDФмЗЂЩњМгГЩЗДгІЩњГЩBЃЌЧыаДГіИУЯЉЬўDЗЂЩњМгОлЗДгІЕФЗНГЬЪН ЃЎ
ЃЈ2ЃЉвдБћЭщЮЊШМСЯжЦзїаТаЭШМСЯЕчГиЃЌЕчГиЕФе§МЋЭЈШыO2 КЭCO2 ЃЌ ИКМЋЭЈШыБћЭщЃЌЕчНтжЪЪЧШлШкЬМЫсбЮЃЎЦфИКМЋЗДгІЪНЮЊ ЃЎ
ЃЈ3ЃЉдкКИНгЭЦсАќЯпЪБЃЌГЃЯШАбЯпЭЗЗХдкЛ№ЩЯЩевЛЛсЃЌвдГ§ШЅЭтВуЕФБЃЛЄЦсЃЌВЂСЂМДдкОЦОЋжаеКвЛЯТдйКИНгЃЎАбЦфжаЕФЕРРэгУЛЏбЇЗНГЬЪНБэЪОЪЧЃК ЃЎ
ЁОД№АИЁП
ЃЈ1ЃЉCH3CH2CH2CH3ЃЛ4ЃЛ ![]()
ЃЈ2ЃЉC3H8+10CO32ЉЉ20eЉ=13CO2+4H2O
ЃЈ3ЃЉ2Cu+O2![]() 2CuO,CuO+CH3CH2OH
2CuO,CuO+CH3CH2OH ![]() Cu+CH3CHO+H2O
Cu+CH3CHO+H2O
ЁОНтЮіЁПНтЃКЃЈ1ЃЉЭщЬўгЩCКЭHдЊЫизщГЩЃЌДѓЧђБэЪОCЃЌаЁЧђБэЪОHЃЌЦфЭЈЪНЮЊCnH2n+2ЃЌЫљвдAЁЂBЁЂCЕФНсЙЙМђЪНЮЊCH3CH3ЁЂCH3CH2CH3ЁЂCH3CH2CH2CH3ЃЌ
ЂйгЩCЁЋO2ЁЋCO2ЃЌ4HЁЋO2ЁЋ2H2OНјааБШНЯЃЌЯћКФ1molO2ЃЌашвЊ12gCЃЌЖјЯћКФ1molO2ЃЌашвЊ4gHЃЌПЩжЊгаЛњЮяКЌЧтСПдНДѓЃЌЕШжЪСПЪБЯћКФЕФO2дНЖрЃЛдђAЁЂBЁЂCЕФзюМђЪНЗжБ№ЮЊCH3ЁЂCH2.6ЁЂCH2.5ЃЌгЩзюМђЪНCHnжаnжЕдНДѓЃЌКЌЧтСПдНИпЃЌЫљвдИљОнЬўЗжзгЕФЛЏбЇЪНПЩжЊЃЌЭъШЋШМЩеЯћКФO2ЕФЮяжЪЕФСПзюЩйЕФгІИУЪЧCH3CH2CH2CH3ЃЌ
ЫљвдД№АИЪЧЃКCH3CH2CH2CH3ЃЛ
ЂкЖўТШДњВњЮяШЁДњЭЌвЛЬМдзгЩЯЕФ2ИіHдзгЃЌга2жжЃКCHCl2CH2CH3ЃЌCH3CCl2CH3ЃЌШЁДњВЛЭЌЬМдзгЩЯЕФHдзгЃЌга2жжЃКCH2ClCHClCH3ЃЌCH2ClCH2CH2ClЃЌЙВга4жжЃЌЫљвдД№АИЪЧЃК4ЃЛ
ЂлЯЉЬўDФмЗЂЩњМгГЩЗДгІЩњГЩBЃЌдђDЮЊCH2=CHCH3ЃЌКЌЫЋМќЃЌПЩЗЂЩњМгОлЗДгІЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ![]() ЃЌ
ЃЌ
ЫљвдД№АИЪЧЃК ![]() ЃЛЃЈ2ЃЉШМСЯЕчГижаЃЌИКМЋЩЯШМСЯЪЇЕчзгЗЂЩњбѕЛЏЗДгІЃЌе§МЋЩЯбѕЛЏМСЕУЕчзгЗЂЩњЛЙдЗДгІЃЌИКМЋЕчМЋЗДгІЪНЮЊC3H8Љ20eЉ+10CO32Љ=13CO2+4H2OЃЌ
ЃЛЃЈ2ЃЉШМСЯЕчГижаЃЌИКМЋЩЯШМСЯЪЇЕчзгЗЂЩњбѕЛЏЗДгІЃЌе§МЋЩЯбѕЛЏМСЕУЕчзгЗЂЩњЛЙдЗДгІЃЌИКМЋЕчМЋЗДгІЪНЮЊC3H8Љ20eЉ+10CO32Љ=13CO2+4H2OЃЌ
ЫљвдД№АИЪЧЃКC3H8+10CO32ЉЉ20eЉ=13CO2+4H2OЃЛЃЈ3ЃЉгУЛ№ЩеЗЈГ§ШЅЦсВуКѓЃЌЭБэУцПЩЩњГЩвЛВуКкЩЋCuOЃЌЛсгАЯьКИНгжЪСПЃЌдкОЦОЋжаеКвЛЯТЃЌввДМФмЛЙдбѕЛЏЭЩњГЩCuЃЌЗДгІдРэЗНГЬЪНЮЊЃК2Cu+O2 ![]() 2CuOЃЌCuO+CH3CH2OH
2CuOЃЌCuO+CH3CH2OH ![]() Cu+CH3CHO+H2OЃЌ
Cu+CH3CHO+H2OЃЌ
ЫљвдД№АИЪЧЃК2Cu+O2 ![]() 2CuOЃЌCuO+CH3CH2OH
2CuOЃЌCuO+CH3CH2OH ![]() Cu+CH3CHO+H2OЃЎ
Cu+CH3CHO+H2OЃЎ
ЁОПМЕуОЋЮіЁПБОЬтжївЊПМВщСЫгаЛњЮяЕФНсЙЙКЭаджЪЕФЯрЙижЊЪЖЕуЃЌашвЊеЦЮегаЛњЮяЕФаджЪЬиЕуЃКФбШмгкЫЎЃЌвзШмгкЦћгЭЁЂОЦОЋЁЂБНЕШгаЛњШмМСЃЛЖрЮЊЗЧЕчНтжЪЃЌВЛвзЕМЕчЃЛЖрЪ§ШлЗаЕуНЯЕЭЃЛЖрЪ§взШМЩеЃЌвзЗжНтВХФме§ШЗНтД№ДЫЬтЃЎ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЛњЮяCH3CH=CHClПЩЗЂЩњЕФЗДгІга:ЂйШЁДњЗДгІ ЂкМгГЩЗДгІ ЂлЯћШЅЗДгІ ЂмЪЙфхЫЎЭЪЩЋ ЂнЪЙЫсадИпУЬЫсМиШмвКЭЪЩЋ ЂогыAgNO3ШмвКЗДгІЕУЕНАзЩЋГСЕэ
ЂпОлКЯЗДгІЃЌе§ШЗЕФЪЧ( )
A. жЛгаЂоВЛФмЗЂЩњ B. жЛгаЂпВЛФмЗЂЩњ
C. жЛгаЂкВЛФмЗЂЩњ D. вдЩЯЗДгІОљПЩЗЂЩњ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЕкVI AзхдЊЫибѕЁЂСђЁЂЮјЕФЫЕЗЈе§ШЗЕФЪЧ
A.бѕЁЂСђЁЂЮјШ§жждЊЫїЕФзюИпе§ЛЏКЯМлОљЮЊ+6B.ЧтЛЏЮяЕФЮШЖЈад:H2O>H2S>H2Se
C.ЧтЛЏЮяЕФЛЙдад:H2O>H2S>H2SeD.ЕЅжЪЕФШлЕу:O2>S>Se
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТНЋбЮЫсШмвКЕЮМгЕНСЊАБ(N2H4)ЕФЫЎШмвКжаЃЌЛьКЯШмвКжаЕФЮЂСЃЕФЮяжЪЕФСПЗжЪ§ІФ(X)Ыц-lg(OH-) БфЛЏЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаа№ЪіДэЮѓЕФЪЧ

ЯТСаа№ЪіДэЮѓЕФЪЧ
A. Kb1(N2H4)=10-6
B. ЗДгІN2H62++N2H4=2N2H5+ЕФPK=9.0 (вбжЊ:pK=-1gK)
C. N2H5C1ШмвКжаc(H+)>c(OH-)
D. N2H5C1ШмвКжаДцдкc(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+(H+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊМздЊЫїЮЛгкЕкIAзхЃЌдзгађЪ§ЮЊaЃЌввдЊЫиЮЛгкЕкVAзхЃЌдђввЕФдзгађЪ§ВЛПЩФмЪЧ
A.a+4B.a+15C.a+28D.a +30
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІжаЃЌЗДгІКѓЙЬЬхЮяжЪжЪСПВЛБфЕФЪЧ
A. дкЪдЙмжаМгШШаЁЫеДђЗлФЉ B. ТСЫПВхШыCu(NO3)2ШмвКжа
C. дкO2жазЦЩеCu2SЪЙжЎзЊЛЏЮЊCuO D. ЫЎеєЦјЭЈЙ§ИпЮТГуШШЕФЬњЗл
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжВЮяЯИАћКЭЖЏЮяЯИАћжаДЂДцФмСПЕФЖрЬЧЗжБ№ЪЧ
A. ЯЫЮЌЫиКЭЬЧд B. ТѓбПЬЧКЭШщЬЧ
C. ЕэЗлКЭЬЧд D. ЦЯЬбЬЧКЭЯЫЮЌЫи
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCu2OжївЊгУгкжЦдьДЌЕзЗРЮлЦсЃЌЫќЪЧвЛжжЯЪКьЩЋЗлФЉЃЌМИКѕВЛШмгкЫЎЃЌдкЪЊПеЦјжаж№НЅбѕЛЏГЩКкЩЋбѕЛЏЭЁЃгУКЌNaOHЕФNa2SO3ШмвКЛЙдCuSO4жЦБИCu2OЕФЙЄвеСїГЬШчЯТЃК

ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉСїГЬжаЩцМАЕФЛЏбЇЗДгІжївЊАќРЈЃК
Ђё.Cu2++2OH-=Cu(OH)2Ё§ЃЛЂђ.ЩњГЩCuOHЃЛЂѓ.2CuOH=Cu2O+H2OЁЃ
аДГіЕкЂђВНЗДгІЕФРызгЗНГЬЪНЃК ______________________________ЁЃ
ЃЈ2ЃЉЦфЫћЗДгІЬѕМўЯрЭЌЪБЃЌВтЕУЗДгІЪБМфКЭШмвКЕФpHЖдCu2OВњТЪЕФгАЯьШчЯТЭМЫљЪОЃК
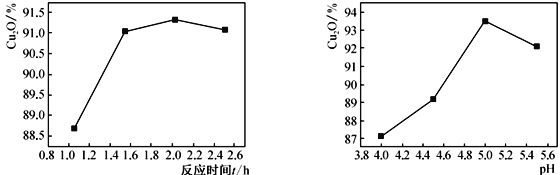
ЂйЗДгІЪБМфГЌЙ§2hЪБЃЌCu2OВњТЪПЊЪМНЕЕЭЦфдвђЪЧ____________________________ЁЃ
ЂкpH<5ЪБЃЌCu2OВњТЪЫцpHМѕаЁЖјМѕаЁЃЌВњЦЗжаЭКЌСПдіМгУїЯдЃЌЦфдвђЪЧ______________________ЃЈгУРызгЗНГЬЪНЫЕУїЃЉЁЃ
ЃЈ3ЃЉЮЊВтЖЈВњЦЗжаCu2OЕФКЌСПЃЌГЦШЁ3.96 gВњЦЗгкзЖаЮЦПжаЃЌМгШы30mLСђЫсЫсЛЏЕФFe2(SO4)3ШмвКЃЈзуСПЃЉЃЌГфЗжЗДгІКѓгУ0.2000 molЁЄL-1БъзМKMnO4ШмвКЕЮЖЈЃЌжСжеЕуЪБЯћКФ50mLБъзМвКЁЃ
ЂйЕЮЖЈЪБгІбЁгУ______(ЬюЁАЫсЪНЁБЛђЁАМюЪНЁБ)ЕЮЖЈЙмЃЌЕЮЖЈжеЕуЕФЯжЯѓЪЧ______________________ЁЃ
ЂкВњЦЗгыСђЫсЫсЛЏЕФFe2(SO4)3ШмвКЗДгІЕФРызгЗНГЬЪНЮЊ________________________________ЁЃ
ЂлМйЖЈдгжЪВЛВЮгыЗДгІЃЌВњЦЗжаCu2OЕФжЪСПЗжЪ§ЮЊ_______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШЫЙЄЩідрПЩВЩгУМфНгЕчЛЏбЇЗНЗЈГ§ШЅДњаЛВњЮяжаЕФФђЫи[CO(NH2)2]ЃЌдРэШчЯТЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ

A. BЮЊЕчдДЕФИКМЋ
B. бєМЋЪвжаЗЂЩњЕФЗДгІвРДЮЮЊЃК2Cl--2e-=Cl2ЁќЃЌCO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
C. ЕчНтНсЪјКѓЃЌвѕМЋЪвШмвКЕФpHгыЕчНтЧАЯрБШвЛЖЈЛсМѕаЁ
D. ШєСНМЋЙВЪеМЏЕНЦјЬх13.44 L(БъзМзДПі)ЃЌдђРэТлПЩШЅГ§ФђЫиЮЊ7.2g(КіТдЦјЬхЕФШмНт)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com