
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成方式如下:
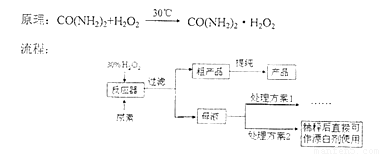
请回答下列问题:
(1)根据反应原理,CO(NH2)2·H2O2分子内存在的作用力
是 。
A.共价键 B.离子键
C.金属键 D.氢键
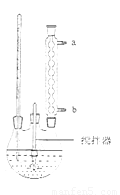
(2)流程图中反应器的装置如图所示,推测该反应的加热方式是 ;回流管中冷水流从 口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是 。
(3)母液处理方案1可以是 (用文字表达)。若欲从母液中离出H2O2和尿素,可采用的操作是 (选填序号)
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(4)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式: MnO4-+ H2O2+ H+= MnO2++ H2O+
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 。(“偏高”、“偏低”或“不变”)。
③根据滴定结果,可确定产品中活性氧的质量分数为 。
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化尿素[CO(NH2)2·H2O2 ]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如下:
试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25—30℃,其主要原因是___________________________________。
(2)从母液中分离出H2O2和尿素,采用的操作是___________。
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000 mol/L KMnO4 标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应)。
①KMnO4溶液应盛放在________式(选填:“酸”、“碱”)滴定管中。
②完成并配平方程式:__MnO4-+___H2O2+___H+=___Mn2++ ____H2O+___ _____
③根据滴定结果,可确定产品中活性氧的质量分数为:___________。
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量______(选填:“偏高”、“偏低”或“不变”)。
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为_________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省高三下学期二轮复习综合测试(4)理综化学部分 题型:填空题
过氧化尿素[CO(NH2)2·H2O2 ]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如下:

试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25—30℃,其主要原因是___________________________________。
(2)从母液中分离出H2O2和尿素,采用的操作是___________。
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000 mol/L KMnO4 标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应)。
①KMnO4溶液应盛放在________式(选填:“酸”、“碱”)滴定管中。
②完成并配平方程式:__MnO4-+ ___H2O2+___H+=___Mn2++ ____H2O+___ _____
③根据滴定结果,可确定产品中活性氧的质量分数为:___________。
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量______(选填:“偏高”、“偏低”或“不变”)。
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成方式如下:
请回答下列问题:
(1)根据反应原理,CO(NH2)2·H2O2分子内存在的作用力
是 。
A.共价键 B.离子键
C.金属键 D.氢键
(2)流程图中反应器的装置如图所示,推测该反应的加热方式是 ;回流管中冷水流从 口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是 。
(3)母液处理方案1可以是 (用文字表达)。若欲从母液中离出H2O2和尿素,可采用的操作是 (选填序号)
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(4)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式: MnO4-+ H2O2+ H+= MnO2++ H2O+
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 。(“偏高”、“偏低”或“不变”)。
③根据滴定结果,可确定产品中活性氧的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com