
分析 (1)CaCO3与稀盐酸溶液反应生成氯化钙、二氧化碳和水,碳酸钙难溶于水,二氧化碳为气体、水为弱电解质,三者要写成化学式形式;
(2)烧碱(NaOH)与稀盐酸(HCl)反应生成氯化钠和水,HCl、NaOH、NaCl均为强电解质,水为弱电解质;
(3)锌(Zn)与稀硫酸(H2SO4)反应生成硫酸锌和氢气,锌、氢气写化学式.
解答 解:(1)CaCO3与稀盐酸溶液反应生成氯化钙、二氧化碳和水,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,离子方程式为:CaCO3+2H+═CO2↑+H2O+Ca2+,
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;CaCO3+2H+═CO2↑+H2O+Ca2+;
(2)烧碱(NaOH)与稀盐酸(HCl)反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O,HCl、NaOH、NaCl均为强电解质,要写成离子形式,水为弱电解质要写成化学式,则离子方程式为H++OH-=H2O,
故答案为:HCl+NaOH=NaCl+H2O;H++OH-=H2O;
(3)锌(Zn)与稀硫酸(H2SO4)发生置换反应,反应方程式为Zn+H2SO4=ZnSO4+H2↑,离子方程式:2H++Zn=Zn2++H2↑,
故答案为:Zn+H2SO4=ZnSO4+H2↑;2H++Zn=Zn2++H2↑.
点评 本题考查了方程式的书写,明确反应实质及方程式书写方法是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.01mol | B. | 0.03mol | C. | 0.05mol | D. | 0.07mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 广泛PH试纸可测定某溶液的PH值为13 | |
| B. | 将PH试纸湿润后,测得的PH值一定有误差 | |
| C. | 用PH试纸蘸取溶液,过半分钟与标准比色卡对比 | |
| D. | 精密pH试纸,测得的PH值一定不能为7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═2H++4SO2- | B. | CuSO4═Cu++SO4- | C. | Ba(OH)2═Ba2++2OH- | D. | FeCl3═Fe2++3Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
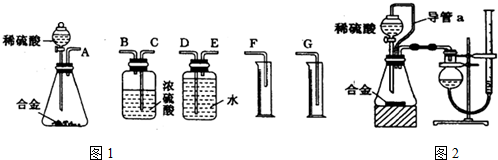
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
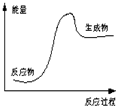
| A. | 该反应为吸热反应 | |
| B. | 该图可以表示石灰石高温分解 | |
| C. | 反应物比生成物稳定 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com