
【题目】ClO2是目前国际上公认的高效、广谱、快速安全的杀菌剂。工业制ClO2的化学反应为2NaClO3 + SO2 + H2SO4=2ClO2 + 2NaHSO4。下列有关该反应的说法正确的是
A. SO2是氧化剂 B. NaClO3被氧化
C. SO2发生了还原反应 D. NaClO3得到电子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有下列仪器或装置,请回答下列问题:
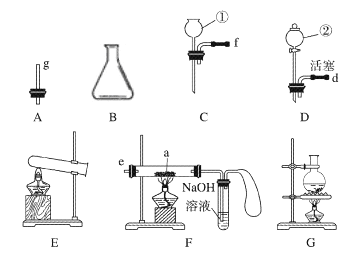
(1)仪器①的名称是_____,②的名称是_____。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是______(填字母);用H2O2与MnO2制O2,并控制产生O2的速率,应选_____(填字母)。
(3)若用装置X进行“排空气法”收集制取的CO2,CO2应从_____(填“b”或“c”)端导入。若瓶中装满水,用排水法收集氧气,氧气应从_____(填“b”或“c”)端导入。
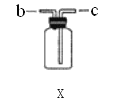
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采用甲酸脱水法(HCOOH![]() CO
CO![]() +H2O),用纯净的CO完成该实验。
+H2O),用纯净的CO完成该实验。
①除F、X外还需要的装置有_____(填字母),X中应加入的试剂是_____,X与其他导管连接的顺序是_____(填导管口的序号);
②实验时 F装置中气球的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.1mol·L-1HF溶液中加入0.1 mol CaCl2固体(不考虑溶液体积变化),则下列说法中错误的是
A. 原HF溶液c(H+)约为6×10-3mol·L-1
B. 加入 CaCl2后溶液中有CaF2沉淀产生
C. 加入CaCl2后溶液中的c(H+)浓度不变
D. 2HF(aq)+Ca2+(aq)=CaF2(s)+2H+(aq)的平衡常数为K=8.88×102
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴是小组对一种度旧合金(含有Cu、Fe、Si等元素)进行分离、回收利用,所设计工艺流程如下。
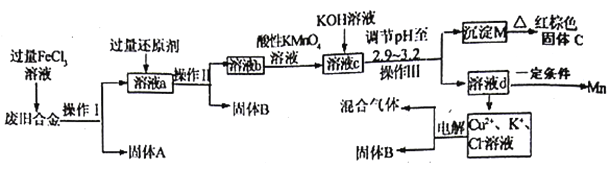
已知298℃时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13,当离子浓度小于1×10-5认为离子沉淀完全。
回答下列问题:
(1)操作I、lI、III为_______,固体A是__________(填化学式)。
(2)加入过量FeC13溶液过程中与较不活泼的金属反应的化学方程式_______。
(3)调节pH至2.9--3.2的目的___________________。
(4)①向溶液b中加入酸性KMn04溶液发生反应的离子方程式为_________________。
②若将溶液b配制成250ml溶液,用滴定管取配制后的溶液25.00m1;再用amol/LKMnO4溶液滴定,恰好反应时消耗KMn04溶液VmL,则流程图中所得红棕色固体C的质量为___g(用含a、v的代数式表示)
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后沉淀的金属离子为____________(填金属阳离子)。
(6)用惰性电极电解(Cu2+、K+、C1-溶液)一段时间后,阴、阳两极均产生标准状况下的气体6.72L,阴极析出固体3.2g,则原溶液C1-的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年8月3日,中国科学家在《Nature》杂志发表论文,合成了一种代号为ICM-101的高能量密度材料。合成该高能物质的主要原料为草酰二肼,结构简式如图所示。下列有关草酰二肼的说法正确的是

A. 可由草酸(HOOC-COOH)和肼(H2N-NH2)发生酯化反应制备
B. 不能发生水解反应
C. 与联二脲(H2NCONHNHCONH2)互为同分异构体
D. 分子中最多有12个原子处于同一平面(已知NH3分子构型为三角锥)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是基本有机化工原料,由乙炔制备聚乙烯醇和顺式聚异戊二烯的合成路线(部分反应条件略去)如图所示:
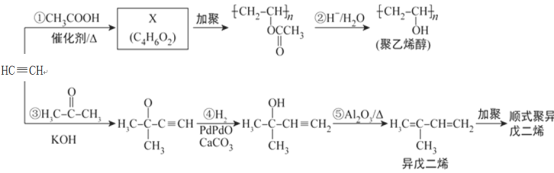
回答下列问题:
(1)按系统命名法命名异戊二烯:________________________________________。
(2)X分子中含有的官能团名称是________________________________________。
(3)反应①~③中,__________(填反应序号)的反应类型与反应④不同,反应⑤属于__________反应。
(4)与乙炔具有相同官能团的异戊二烯的同分异构体共有__________种。
(5)X的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是__________(选填字母)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(6)顺式聚异戊二烯的结构式是(选填字母)__________。
a.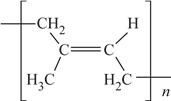 b.
b.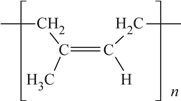
c.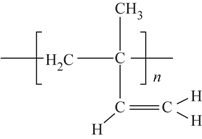 d.
d.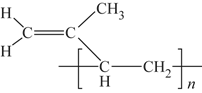
(7)参照异戊二烯的上述合成路线,设计一条由乙烯和乙醛为起始原料制备1,3-丁二烯的合成路线:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,a、b均为惰性电极,在直流电场的作用下,中间隔室的Na+、SO42-可分别通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列有关说法正确的是
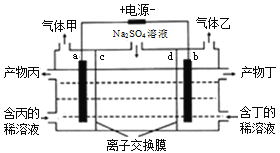
A. a极的电极反应式为2H2O+2e-=H2↑+2OH-
B. c为阳离子交换膜,d为阴离子交换膜
C. 气体乙为O2,产物丁为硫酸
D. 若撤去离子交换膜c、d再电解硫酸钠溶液,则不能制得硫酸和烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当向蓝色的硫酸铜溶液中逐滴加入氨水,观察到溶液呈深蓝色时,再通入SO2气体,生成了白色沉淀,将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下述描述正确的有( )
A. Cu2+和Ag+相似,能与NH3结合生成铜氨配离子
B. 白色沉淀为+2价铜的某种亚硫酸盐,溶于稀硫酸发生复分解反应
C. 白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,只发生氧化反应
D. 反应过程中消耗的SO2与生成的SO2的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com