

| A.Cu(s)+2H2O(l)===2Cu(OH)2 (s)+H2(g),该反应可通过上图装置来实现 |
B.在体积可变的密闭容器中进行反应:CaCO3(s) CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动 CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动 |
| C.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH<0,由该反应可知物质能量关系一定符合:E [ZnSO4(aq)] < E [CuSO4(aq)] |
D.在密闭容器中进行反应:HI(g)  1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量 1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量 |
科目:高中化学 来源:不详 题型:单选题
| A.低温下自发进行,高温下非自发进行 | B.任何温度下均为非自发进行 |
| C.高温下自发进行,低温下非自发进行 | D.任何温度下均为自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2Z(g)
2Z(g)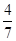 。
。 aX(g)+3Y(g)的平衡常数。
aX(g)+3Y(g)的平衡常数。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非自发的反应即不可能进行的反应 |
| B.自发反应即在任何条件下都能进行的反应 |
| C.绝大多数的放热反应都能自发进行,且反应热越大,反应进行得越完全 |
| D.吸热反应在常温、常压下不能自发进行,只有在高温下才可能自发进行。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
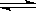 pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是( )。
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是( )。| A.(m+n)必定小于p | B.(m+n)必定大于p |
| C.m必定小于p | D.n必定大于p |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铵与氢氧化钡晶体混合研磨,很快会闻到刺激性气味 |
| B.冬天一杯热水很快变冷 |
| C.有序排列的火柴散落时成为无序排列 |
| D.多次洗牌以后,扑克牌毫无规律的混乱排列的几率大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 根据图回答:
根据图回答: 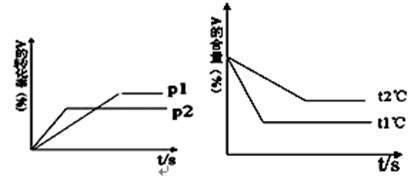
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 于判断过程方向的说法正确的是( )
于判断过程方向的说法正确的是( )| A.所有自发进行的化学反应都是放热反应 |
| B.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| C.由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.白色沉淀为ZnS,而黑色沉淀为CuS |
| B.上述现象说明ZnS的Ksp小于CuS的Ksp |
| C.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| D.该过程破坏了ZnS的溶解平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com