
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
A.x的值为1
B.用B的浓度变化表示的平均反应速率为0.2 mol·L-1·min-1
C.反应开始前A的物质的量为3 mol
D.5 min时A的浓度为0.2 mol·L-1
科目:高中化学 来源:2015-2016学年吉林省高一入学摸底化学试卷(解析版) 题型:选择题
在三个容积相同的密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
A.p(Ne)>p(H2)>p(O2)
B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne)
D.p(H2)>p(Ne)>p(O2)
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期一模化学试卷(解析版) 题型:实验题
硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:

(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:______________。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是__________。
(3)滤渣c是_________。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2===2NO2、_________。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:______________。
某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:______________。

查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次月考化学试卷(解析版) 题型:选择题
298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+ 。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是

A.正极电极反应为Zn-2e-=== Zn2+
B.左边烧杯中溶液的红色变浅
C.Pt电极上有气泡出现
D.该电池的总反应为:3Zn+2Fe3+=== 3Zn2++2 Fe
查看答案和解析>>
科目:高中化学 来源:2016届广东省等六校高三第一次联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4 LSO3含有NA个分子
B.6.4g氧气和3.2g臭氧(O3)混合气体所含有的氧原子数为0.6NA
C.过氧化钠与CO2反应时,0.1mol过氧化钠转移的电子数为0.2NA
D.标准状况下,2.24L Cl2与过量的稀FeCl2溶液反应,转移电子总数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中高二上期初考试化学试卷 (解析版) 题型:选择题
下列叙述是小明做完铜、锌原电池的实验后得出的结论和认识,你认为正确的是
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.电子沿外导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷(解析版) 题型:选择题
一定条件下的反应:PCl5(g)  PCl3(g)+Cl2(g)(△H>0)达到平衡后,下列情况使PCl5分解率降低的是
PCl3(g)+Cl2(g)(△H>0)达到平衡后,下列情况使PCl5分解率降低的是
A.温度、体积不变,充入氩气 B.体积不变,对体系加热
C.温度、体积不变,充入氯气 D.温度不变,增大容器体积
查看答案和解析>>
科目:高中化学 来源:2016届山西省忻州市高三上学期第一次月考化学试卷(解析版) 题型:实验题
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂。其生产流程如下:
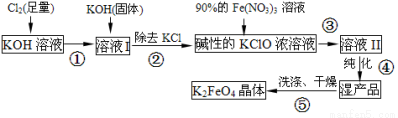

(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KclO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为 mol。从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图2所示。电解过程中阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省佛山市高三上学期第一次月考化学试卷(解析版) 题型:选择题
对于常温下pH=3的乙酸溶液,下列说法正确的是
A.与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多
B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH升高
D.溶液中粒子浓度大小关系为: c(H+)>c(CH3COOH) > c(CH3COO-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com