
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件, 能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅, 其反应如下: 3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)在一定温度下进行上述反应, 若反应容器的容积为2 L, 3 min后达到平衡, 测得固体质量增加了2. 80 g, 则转移电子的物质的量为 ,H2的平均反应速率为 mol/(L·min); 该反应的平衡常数表达式K= 。
(2)上述反应达到平衡后, 下列说法正确的是 。
a. 其他条件不变, 压强增大, 平衡常数K减小
b. 其他条件不变, 温度升高, 平衡常数K减小
c. 其他条件不变, 增大Si3N4物质的量,平衡向左移动
d. 其他条件不变, 增大HCl物质的量,平衡向左移动
(3)一定条件下, 在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是 。
| A.3v逆(N2)=v正(H2) | B.v正(HCl)=4v正(SiCl4) |
| C.混合气体密度保持不变 | D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6 |
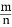 , 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比
, 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。 (1)0.24mol 0. 02  (2)bd (3)ac (4)<
(2)bd (3)ac (4)<
解析试题分析:(1)2.80/(3*28+4*14)*3*4=0.24mol;
2.80/(3*28+4*14)*6/3/2="0.02" mol/(L·min);
平衡常数是指可逆化学反应达到平衡时,每个产物浓度系数次幂的连乘积与每个反应物浓度系数次幂的连乘积之比;
(2)a、温度不变,加压或改变反应物的浓度等平衡常数不变,错误;b、因反应为放热反应,故反应达到平衡后,升高温度,平衡逆向移动,平衡常数K减小,正确;c、其他条件不变,增加固体Si3N4平衡不移动,错误;d、其他条件不变,增大HCl的物质的量,平衡向消耗HCl的逆反应方向移动,d正确。)
(3)利用化学反应速率之比等于化学方程式计量系数比可知a项叙述表示v正=v逆,表示反应达到平衡态,正确;b项均表示正反应,无论反应是否处于平衡态,都成立,错误;c、混合气体密度不变说明溶液中气体质量不变,而平衡移动则气体质量改变,所以c项表示达到平衡态,正确;d项表示的浓度关系与是否平衡无关,错误。
(4)降低温度,平衡正向移动,n(H2)/n(HCl)变小。
考点:化学平衡。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:填空题
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,正确的是 。(填字母)
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)该反应平衡常数K的表达式为 。
(3)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时问变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)为 mol·L-1·min-1。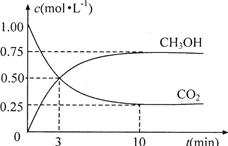
(5)下列措施中能使(4)中n(CH3OH)/n(CO2)增大的有 。(填字母)
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1molCO2和3molH2
E.充入He(g),使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) 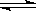 CH3OH(g)
CH3OH(g)
(1)不同温度下的平衡转化率与压强的关系如图所示。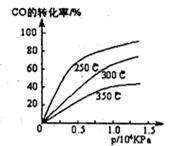
①该反应△H 0,△S 0(填“>”或“<”),则该反 自发进行(填“一定能”、“一定不能”、“不一定”)实际生产条件控制在250℃、l.3×l04kPa左右,选择此压强的理由是 。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)="0.l" mol·L -1。
①该反应的平衡常数K= :
②在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是 (填序号)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
| D.重新平衡时n(H2)/n(CH3OH)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,其反应为:3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g) ΔH<0
CH3OCH3(g)+CO2(g) ΔH<0
(1)在一定条件下的密闭容器中,该反应达到平衡后,只改变一个条件能同时提高反应速率和CO的转化率的是________(填字母代号,下同)。
a.降低温度 b.加入催化剂
c.缩小容器体积 d.减少CO2的浓度
(2)若反应在体积恒定的密闭容器中进行,下列能判断反应已达平衡状态的是________
a.3V正(CO2)=V逆(CO) b.生成a mol CO2的同时消耗3a mol H2
c.气体的密度不再改变 d.混合气体的平均相对分子质量不变
(3)300℃时,在体积为2L的容器中充入4 mol H2、6 mol CO。5min时,反应恰好达平衡,此时H2的转化率为75%。
① 5min时V(CO)=_________mol/(L·min)。该温度下,此反应的平衡常数为:_______
② 保持温度不变,在以上已达反应平衡的容器中,将每种物质同时增加1mol,则此时平衡将_______移动(填“正向”、“逆向”、“不”)
(4).下图中,甲装置为CH3OCH3、O2、KOH三者构成的燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
① 写出甲装置中A极的电极反应式___________________________________________
② 写出乙装置中C极的电极反应式___________________________________________
③ 当有23克甲醚参加反应时,D电极的质量变化为______克。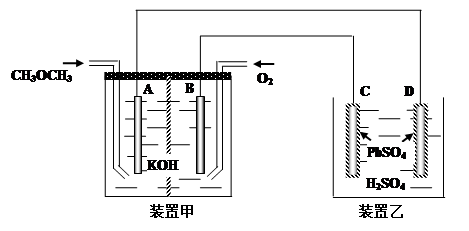
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g) 2SO3(g) ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
2SO3(g) ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知重铬酸钾(K2Cr2O7)是一种主要的的无机试剂。
(1)强氧化性的K2Cr2O7溶液中,存在如下平衡: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+,
2CrO42-(黄色)+2H+,
①若要使溶液的橙色加深,下列可采用的方法是 。
| A.加入适量稀盐酸 | B.加入适量稀硫酸 | C.加入适量烧碱固体 | D.加水稀释。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)  2SO3(g),ΔH < 0的正、逆反应速率的影响如图所示:
2SO3(g),ΔH < 0的正、逆反应速率的影响如图所示:
(1)加催化剂对反应速率影响的图像是________(填序号,下同),平衡________移动。
(2)升高温度对反应速率影响的图像是________,平衡向________方向移动。
(3)增大反应容器体积对反应速率影响的图像是________,平衡向________方向移动。
(4)增大O2的浓度对反应速率影响的图像是__________,平衡向________方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(共11分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法
该法的工艺流程为: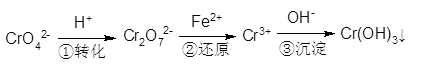
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O2- 7和CrO2- 7的浓度相同 B.2v(Cr2O2- 7)=v(CrO2- 4) C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s)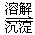 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因是(用电极反应式解释) 。溶液中同时生成的沉淀还有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com