
(12分)H、C、N、O是几种重要的非金属元素。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是 。
(2)H3O+中H—O—H的键角比H2O中H—O—H的键角大,是因为 。
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子的电子式 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)==3N2(g)+4H2O(g) △H=-1038.7 kJ/mol
若该反应中有4mol N—H键断裂,则形成的π键有___________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a、离子键 b、共价键 c、配位键 d、范德华力
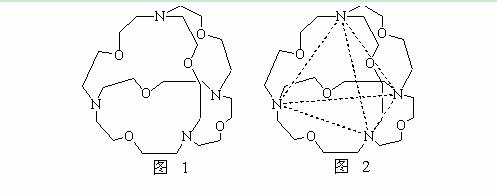
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是 (填标号)。
a、CF4 b、 CH4 c、 NH4+ d、H2O

科目:高中化学 来源: 题型:
(12分)H、C、N、O是几种重要的非金属元素。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是 。
(2)H3O+中H—O—H的键角比H2O中H—O—H的键角大,是因为 。
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子的电子式 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)==3N2(g)+4H2O(g) △H=-1038.7 kJ/mol
若该反应中有4mol N—H键断裂,则形成的π键有___________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a、离子键 b、共价键 c、配位键 d、范德华力
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是 (填标号)。
a、CF4 b、 CH4 c、 NH4+ d、H2O
查看答案和解析>>
科目:高中化学 来源:2010—2011学年度河南大学附中高二下学期期末考试化学试卷 题型:填空题
(12分)H、C、N、O是几种重要的非金属元素。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是 。
(2)H3O+中H—O—H的键角比H2O中H—O—H的键角大,是因为 。
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子的电子式 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)==3N2(g)+4H2O(g) △H=-1038.7 kJ/mol
若该反应中有4mol N—H键断裂,则形成的π键有___________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a、离子键 b、共价键 c、配位键 d、范德华力
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是 (填标号)。
a、CF4 b、 CH4 c、 NH4+ d、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(本题共6分)
(1)化学是生命的语言,生命是建筑在原子、分子与复杂的化学反应之上的。根据大部 分已被接受的模型,宇宙开始于150亿年前的一次大爆炸,至今宇宙还在持续扩张。就整体 而言,当宇宙冷却时,宇宙的历史可以看作是从元素到复杂的粒子弋系列的收缩。当然,正如我们所知,生命在室温的地球是一种奇特的现象。
大部分的轻元素,如氢及氦,在大爆炸后扩张的几分钟内即形成。在宇宙中,当星球形 成时温度将由下降而开始回升。在化学领域中,星球是很重要的,因为生命所需的重元素是 由星球内部温度超过一千万度制造出来的。合理地排列下列的字符串,使其能符合宇宙中超 过99%都为氢或氦的事实。
a一( )一一( )一( )一( )-( )一-( )一( )
a.夸克→质子,中子
b.1014细胞→人类
c.H,C,N,O→H2,CH4,NH3,H20(在宇宙中)
d.质子,氦原子核+电子→中性H,He原子
e.蛋白质,核苷酸,细胞膜→第一个细胞
f.质子,中子→氦原子核
g.H2,He,CH4,NH3,H2O,灰尘→太阳系
h.H,He原子→再解离,第一个星球与银河生成
i.质子,氦原子(轻元素)→重元素,如C,N,O,只S,Fe,U;超新星爆炸
j.H2,CH4,NH3,H20等→地球上的氨基酸,糖类,氨基酸碱基,磷酸酯
(2)人体是由细胞所组成的,而细胞由原子组成。人体大约三分之二的质量是水,这表示细胞大约三分之二的质量是水。估算一个重60kg的人体约由多少个原子组成。(提示:可考虑一个水分子中三个原子的平均相对原子质量,再由你自己考虑其它分子如蛋白质、脂肪或碳水化合物的平均相对原子质量)
查看答案和解析>>
科目:高中化学 来源: 题型:
H、C、N、O是几种重要的非金属元素。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是 。
(2)H3O+中H—O—H的键角比H2O中H—O—H的键角大,是因为 。
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子的电子式 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)==3N2(g)+4H2O(g) △H=-1038.7 kJ/mol
若该反应中有4mol N—H键断裂,则形成的π键有___________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a、离子键 b、共价键 c、配位键 d、范德华力
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是 (填标号)。
a、CF4 b、 CH4 c、 NH4+ d、H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com