
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
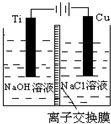
| 方法Ⅱ | 电解法,反应为2Cu+H2O Cu2O+H2↑. Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
 O2(g)=Cu2O(s)△H=-169kJ?mol-1
O2(g)=Cu2O(s)△H=-169kJ?mol-1 O2(g)=CO(g)△H=-110.5kJ?mol-1
O2(g)=CO(g)△H=-110.5kJ?mol-1 O2(g)=CuO(s)△H=-157kJ?mol-1
O2(g)=CuO(s)△H=-157kJ?mol-1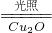 2H2(g)+O2(g)△H>0
2H2(g)+O2(g)△H>0| 序号 | 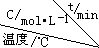 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
 O2(g)=CO(g)三个反应的和,
O2(g)=CO(g)三个反应的和, 2Cu2O+N2↑+6H2O,故答案为:4Cu(OH)2+N2H4
2Cu2O+N2↑+6H2O,故答案为:4Cu(OH)2+N2H4 2Cu2O+N2↑+6H2O;
2Cu2O+N2↑+6H2O; =
=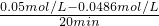 =7×10-5 mol?L-1 min-1,故B正确;
=7×10-5 mol?L-1 min-1,故B正确; 来计算;
来计算;

科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
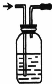 为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验: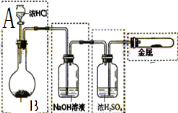 ______
______查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
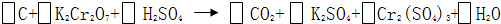
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
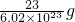
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com