
| A、一定温度下,反应2NaCl(s)═2Na(s)+Cl2(g)的△H<0,△S>0 |
| B、NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| D、由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
| A、氨水 | B、NaOH溶液 |
| C、稀硫酸 | D、浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| C、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
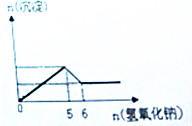 某溶液中可能大量含有Mg2+,Cu2+,Al3+,Cl-,OH-,CO32-.当加入氢氧化钠溶液时,生成白色沉淀的物质的量与加入氢氧化钠的物质的量关系如图所示.
某溶液中可能大量含有Mg2+,Cu2+,Al3+,Cl-,OH-,CO32-.当加入氢氧化钠溶液时,生成白色沉淀的物质的量与加入氢氧化钠的物质的量关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、④⑤ |
| C、②④⑤ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO3+ClO-→H++SO42-+Cl- |
| B、SO2+ClO-+H2O→H++SO42-+Cl- |
| C、SO2+ClO-+H2O→SO32-+HClO |
| D、SO2+ClO-+2OH-→SO42-+Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% |
| B、福尔马林可浸制标本,利用了其使蛋白质变性的性质 |
| C、“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
| D、绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、核内有7个中子 |
| B、核内有6个质子 |
| C、质量数为13 |
| D、与石墨互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com