
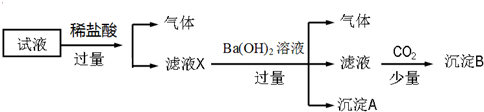
| A. | 无法确定原试液中是否含有Fe3+、K+ | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ | |
| C. | 无法确定沉淀B的成分 | |
| D. | 原溶液中一定存在的离子为NH4+、Fe2+、NO3-、SO42- |
分析 试液中加入盐酸产生气体,说明一定含有硝酸根离子和二价铁离子;滤液中加入氢氧化钡生成沉淀,说明一定含有氨根离子,因为加入盐酸,在酸性环境下二价铁离子被氧化生成三价铁,产生氢氧化铁沉淀,二价铁离子与偏铝酸根离子发生双水解,不共存,所以一定不含有偏铝酸根离子,加入氢氧化钡溶液产生气体,则一定含有氨根离子,产生沉淀A,该沉淀可能是氢氧化铁或者硫酸钡,滤液中含有大量钡离子、氢氧根离子,通入二氧化碳,得到沉淀B为碳酸钡沉淀,因为存在的离子浓度均为0.1mol•L-1,从电荷的角度出发,判断是否含有钾离子和硫酸根离子,据此解答.
解答 解:试液中加入盐酸产生气体,硝酸根离子、二价铁离子在酸性环境下发生氧化还原反应生成三价铁离子和一氧化氮,说明一定含有硝酸根离子、二价铁离子;二价铁离子与偏铝酸根离子发生双水解不共存,一定不含偏铝酸根离子,向滤液中加入足量氢氧化钡,产生气体,氢氧根离子与氨根离子反应生成氨气,一定含有氨根离子,因为第一步反应中生成三价铁离子,所以加入氢氧化钡会产生氢氧化铁沉淀或者硫酸钡,滤液中含有大量钡离子、氢氧根离子,通入二氧化碳,得到沉淀B为碳酸钡沉淀,因为存在的离子浓度均为0.1mol•L-1,依据溶液中阴阳离子所带电荷守恒可知:硫酸根离子一定存在;三价铁离子,一定不存在;
一定不存在的是:Fe3+、AlO2-;
所以一定含有的离子有:NH4+、Fe2+、NO3-、SO42-;
无法确定的是:K+、Cl-,
A.通过实验现象无法确定是否含有Cl-、K+,故A错误;
B.滤液X中大量存在的阳离子有NH4+、H+、Fe2+,不含有铝离子,故B错误;
C.沉淀B的成分为碳酸钡沉淀,故C错误;
D.原溶液中一定存在的离子为NH4+、Fe2+、NO3-、SO42-,故D正确;
故选:D.
点评 本题考查了常见离子的性质检验,熟悉离子的性质及检验方式是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
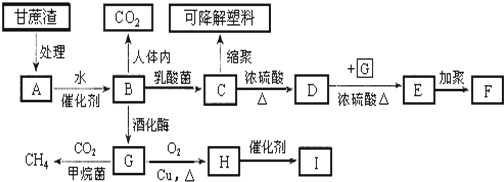
 ;六元环状化合物I
;六元环状化合物I .
.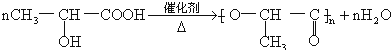 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
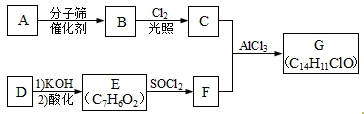
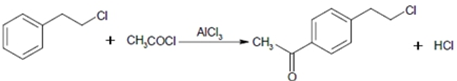
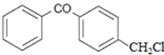 .
.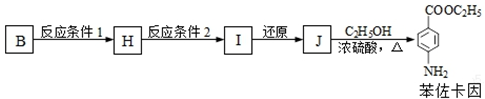
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
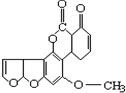
| A. | 1mol该化合物最多消耗H2和NaOH分别为6 mol和2 mol | |
| B. | 该化合物中含有三种官能团 | |
| C. | 该化合物中含有2个苯环结构 | |
| D. | 该化合物可以和1mol Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

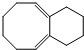 )与乙烯通过烯烃复分解进行如图所示的一系列反应:
)与乙烯通过烯烃复分解进行如图所示的一系列反应: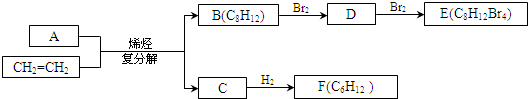
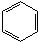 $\stackrel{Ⅰ}{→}$ X $\stackrel{Ⅱ}{→}$ Y $\stackrel{Ⅲ}{→}$ C,步骤Ⅰ所用的试剂和条件是液溴、溴化铁催化,步骤Ⅱ的反应类型为加成,写出步骤Ⅲ的化学反应方程式
$\stackrel{Ⅰ}{→}$ X $\stackrel{Ⅱ}{→}$ Y $\stackrel{Ⅲ}{→}$ C,步骤Ⅰ所用的试剂和条件是液溴、溴化铁催化,步骤Ⅱ的反应类型为加成,写出步骤Ⅲ的化学反应方程式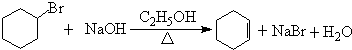

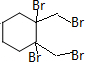 +4KOH
+4KOH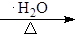
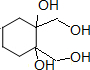 +4KBr.
+4KBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
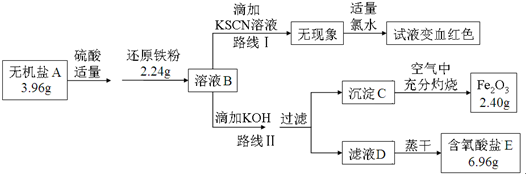
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Mn | Fe | |
| 电离能 KJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| D. | 实验室可以用浓硫酸与氯化钠固体共热制取氯化氢气体,因此浓硫酸与碘化钠固体共热也能制取碘化氢气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com