
某校化学研究性学习小组欲设计实验验证Al、Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
_____________ 、_____________ 相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为 。
(2)①若用Fe、Cu作电极设计成原电池,以确定Fe、Cu的活动性。试在下面方框中画出原电池装置图,标出原电池的电极材料和电解质溶液。
上述装置中正极反应式为 。
②某小组同学采用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用 。
| A.0.5 mol·L-1氯化亚铁溶液 | B.0.5 mol·L-1氯化铜溶液 |
| C.0.5 mol·L-1盐酸 | D.0.5 mol·L-1氯化亚铁和0.5 mol·L-1氯化铜混合溶液 |
(1)盐酸的浓度(1分);溶液的温度(1分); 硫酸亚铁溶液(或其他的亚铁盐溶液)(2分);
(2)①(2分) 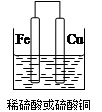
2H+ + 2e- = H2↑ 或Cu2+ + 2e-= Cu (2分)
②D (2分)
(3) 取适量的氯化铝溶液,用pH试纸测其pH值小于7,则证明氢氧化铝为弱碱。(2分)
解析试题分析:(1)要验证Al、Fe、Cu的金属活动性,除选择大小相同的金属片外,还需要控制盐酸的浓度和溶液的温度相同,还可以用硫酸亚铁溶液(或其他的亚铁盐溶液)来验证三种金属的活泼性;(2)①若用Fe、Cu作电极设计成原电池,则Fe为负极,Cu为正极,可以用稀硫酸或者是硫酸铜为电解质溶液,所以该装置图为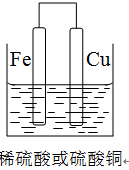 ,若电解质为稀硫酸,则正极反应式为 2H+ + 2e- = H2↑,若电解质溶液为硫酸铜,则正极反应式为Cu2+ + 2e-=" Cu" ;②用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用0.5 mol·L-1氯化亚铁和0.5 mol·L-1氯化铜混合溶液;(3)可以测定铝的强酸盐的pH来判断,其实验过程为取适量的氯化铝溶液,用pH试纸测其pH值小于7,则证明氢氧化铝为弱碱。
,若电解质为稀硫酸,则正极反应式为 2H+ + 2e- = H2↑,若电解质溶液为硫酸铜,则正极反应式为Cu2+ + 2e-=" Cu" ;②用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用0.5 mol·L-1氯化亚铁和0.5 mol·L-1氯化铜混合溶液;(3)可以测定铝的强酸盐的pH来判断,其实验过程为取适量的氯化铝溶液,用pH试纸测其pH值小于7,则证明氢氧化铝为弱碱。
考点:原电池,盐类水解
点评:本题利用原电池的知识来设计实验比较金属的活动性,这有利于培养学生的探究性思维,该题难度适中。


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某校化学研究性学习小组设计如下实验方案,测定放置己久的小苏打样品中纯碱的质量分数.
某校化学研究性学习小组设计如下实验方案,测定放置己久的小苏打样品中纯碱的质量分数.查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江哈尔滨市第六中学高三上学期期末考试化学试卷 题型:填空题
(14分)某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2012届黑龙江哈尔滨市高三上学期期末考试化学试卷 题型:填空题
(14分)某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com