
 4NO+6H20;4NO+3O2+2H2O=4HNO3 设原混合气体中有x mol O2,最后容器中生成y mol HNO3,再向容器中注入一定量的H2O,得到溶液.
4NO+6H20;4NO+3O2+2H2O=4HNO3 设原混合气体中有x mol O2,最后容器中生成y mol HNO3,再向容器中注入一定量的H2O,得到溶液. CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O; 4NO+6H20Ⅰ;
4NO+6H20Ⅰ;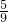 ;
;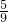 ;
; 4NO+6H20Ⅰ;
4NO+6H20Ⅰ;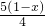
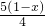 mol,剩余氧气
mol,剩余氧气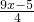 mol,
mol,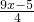 mol ymol
mol ymol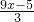
 ,
, 4NO+6H20Ⅰ;
4NO+6H20Ⅰ;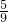
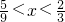 .
.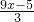 ;
;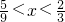 .
.

科目:高中化学 来源: 题型:阅读理解
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② … |
若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
| ||
| ||
| ||
 CO+3H2
CO+3H2 CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如上左图所示.
CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如上左图所示.查看答案和解析>>
科目:高中化学 来源:2010-2011学年河北省高三一轮复习检测三化学试卷 题型:填空题
(14分)Ⅰ.下列实验操作或对实验事实的描述正确的是 (填序号)
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉;
② 配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低;
③ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
④ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑤ 向NaOH溶液、KSCN溶液、沸腾的蒸馏水中分别滴加饱和的FeCl3溶液得到的分散系依次为:浊液、溶液、胶体
Ⅱ.某研究性学习小组利用下图所示装置研究乙醇与氧化铁的反应,请回答下列问题:

(1)装置中试管B的作用是 。
(2)实验中可观察到石英管A中的现象为 。
(3)反应停止后,取出试管C在酒精灯上加热至沸腾,可观察到有红色沉淀产生。写出该反应的化学方程式 。
(4)为了测定反应后石英管A左侧固体中铁元素的含量,进行如下实验:

(i)步骤③中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(ii)下列有关步骤④的操作中说法正确的是 。
a.滴定过程中可利用淀粉溶液作为指示剂
b.滴定管用蒸馏水洗涤后可以直接装液
c.锥形瓶不需要用待测夜润洗
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
(iii)由框图中数据计算,可得石英管A左侧固体中铁元素的百分含量为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省等三校高三2月联考理综化学部分 题型:填空题
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
写出银氨溶液与乙醛反应生成银镜的化学方程式:
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
|
①测定上述实验用的Fe(NO3)3溶液的pH值 ②配制 溶液,并将适量此溶液加入 内。 …… |
若 ,假设2成立。 若 ,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由: 。
查看答案和解析>>
科目:高中化学 来源:2010年6月浙江省金温七校高二化学期末卷 题型:填空题
(13分)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe1+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
|
① ② …… |
若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com