
(18分)
Ⅰ.某温度下,向某密闭容器中加入1 mol N2和3 mol H2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m。假设N2、H2、NH3的加入量(单位:mol)用x、y、z表示,应满足:
(1)恒定温度、体积
①若x = 0,y = 0,则z =_________;
②若x = 0.75,y = _________,则z =_________;
③x、y、z应满足的一般条件是_______________________________。
(2)恒定温度、压强
①若x = 0,y = 0,则z _________;
②x、y、z应满足的一般条件是_______________________________。
Ⅱ.将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)  2H2+O2、2CO+O2
2H2+O2、2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_____和_____,或____和_____。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为: n(O2)平=a mol,n(CO2)平=b mol。
试求n(H2O)平=__________。(用含a、b的代数式表示)
Ⅰ(1)? 2 ? 0.75 0.5 ? x+z/2=1 y+3z/2=3
(2) ? 任意数值 ? x/y=1/3;Z≧0
Ⅱ.(1)H2O、H2,CO、CO2 (2)(2-2a+b) mol
解析Ⅰ.(1)恒定温度、体积
①用一边倒法解,1 mol N2和3 mol H2,使之完全转化成NH3,是2mol,z=2
②用一边倒法解:
N2 + 3H2 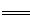 2NH3
2NH3
起始 x y z
转化 z/2 3z/2 z
一边倒: x+z/2 y+3z/2 0
x+z/2="1," y+3z/2=3,解得:x = 0.75,y =0.75,z=0.5
③由②得x+z/2=1 y+3z/2=3
(2)恒定温度、压强
用一边倒法解:
N2 + 3H2  2NH3
2NH3
起始 x y z
转化 z/2 3z/2 z
一边倒:x+z/2 y+3z/2 0
所以有方程:(x+z/2):(y+3z/2)=1:3 y=3x(也就是说与Z无关)
①任意数值 ? x/y=1/3;Z≧0
Ⅱ..(1)H2O、H2,CO、CO2
⑵ 2H2O(g)  2H2+O2、2CO+O2
2H2+O2、2CO+O2 2CO2
2CO2
始 2 2
变 2a-b a -b/2 -b/2 -b/2 b
平 2-2a+b a b
n(H2O)平=(2-2a+b) mol


科目:高中化学 来源: 题型:
研究和开发CO2 和CO的创新利用是环境保护和资源利用
的双赢的课题。
I.CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密
闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇;
![]() 平衡时CO的转化率与温度,压强的关系如下图:
平衡时CO的转化率与温度,压强的关系如下图:
 (1)100℃时,该反应的平衡常数:
(1)100℃时,该反应的平衡常数:
K= ;(用a、b的代数式表
示)。若一个可逆反应的平衡常数K值
很 大,对此反应的说法正确的是:
(填序号)
A.该反应使用催化剂意义不大;
B.该反应发生将在很短时间内完成;
C. 该反应达到平衡时至少有一种反应物
百分含量很小;
D.反应物的转化率一定高:
(2)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,达到平衡时
CO转化率 (填“增大”,“不变”或“减小”,下同)平衡常数: 。
(3)在某温度下,向一容积不变的密闭容器中充入2.5molCO,7.5molH2,反应生成CH3OH
(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时的压强 倍。
11.某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂
作用下可制得甲烷,己知:
![]()
则![]() 和
和![]() 反应生成液态水的热化学方程式为:
反应生成液态水的热化学方程式为:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com