
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,124gP4中所含P—P键数目为4NA
B.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
C.17g甲基(—14CH3)所含的电子数目为10NA
D.1.5molFeI2与22.4LCl2完全反应时转移的电子数为2NA
【答案】B
【解析】
A.124gP4中分子的物质的量为![]() =1mol,P4分子为正四面体形,4个P原子位于四个顶点,所以一个P4分子中有6个P—P键,所以124gP4中所含P—P键数目为6NA,故A错误;
=1mol,P4分子为正四面体形,4个P原子位于四个顶点,所以一个P4分子中有6个P—P键,所以124gP4中所含P—P键数目为6NA,故A错误;
B.1molCH4含氢原子为4mol,1molC2H4含氢原子为4mol,所以标准状况下,11.2L即0.5mol甲烷和乙烯混合物中含氢原子为2mol,即2NA,故B正确;
C.1个甲基(—14CH3)所含电子数为6+3=9,17g甲基(—14CH3)的物质的量为![]() =1mol,所含电子数为9 NA,故C错误;
=1mol,所含电子数为9 NA,故C错误;
D.氯气所处的状态不明确,故其物质的量无法计算,所以无法确定反应过程中何种物质过量,无法确定转移的电子数,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】等物质的量的PCl5(g)分别放入起始体积相同的恒压容器A和恒容容器B中,相同温度下反应:PCl5(g)![]() PCl3(g)+Cl2(g)达到平衡时,两容器PCl5分解率(用X表示)相比
PCl3(g)+Cl2(g)达到平衡时,两容器PCl5分解率(用X表示)相比
A.XA>XBB.XA<XB
C.XA=XBD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。下列说法不正确的是

A.该分解过程是:2NO![]() N2+O2
N2+O2
B.实验室制取NO可以用铜与稀硝酸反应
C.过程②释放能量,过程③吸收能量
D.标准状况下,NO分解生成5.6 LN2转移电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A. H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH﹣+H++![]() →BaSO4↓+H2O
→BaSO4↓+H2O
B. 将Na投入到CuSO4溶液中:2Na+Cu2+===2Na++Cu↓
C. 大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO﹣+CO2↑+H2O
D. 将Cl2通入水中:Cl2+H2O===2H++Cl﹣+ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4-2H2O,M=180g.mol-1)为淡黄色固体,难溶于水,可用作电池正极材料磷酸铁锂的原料。回答下列问题:
实验1探究纯草酸亚铁晶体热分解产物
(1)气体产物成分的探究,设计如下装置(可重复选用)进行实验:
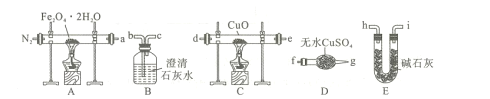
①装置B的名称为 ____。
②按照气流从左到右的方向,上述装置的连接顺序为a→___ →点燃(填仪器接口的字母编号)。
③为了排尽装置中的空气,防止加热时发生爆炸,实验前应进行的操作是____。
④C处固体由黑变红,其后的澄清石灰水变浑浊,则证明气体产物中含有____。
(2)固体产物成分的探究,待固体热分解充分后,A处残留黑色固体。黑色固体可能是Fe或FeO,设计实验证明其成分为FeO的操作及现象为____。
(3)依据(1)和(2)结论,A处发生反应的化学方程式为____。
实验2草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的流程如下图:

(4)草酸亚铁晶体溶解酸化用KMnO4溶液滴定至终点的离子方程式为____。
(5)草酸亚铁晶体样品的纯度为 ____(用代数式表示),若配制溶液时Fe2+被氧化,则测定结果将____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3-+H2O-2e-=C1O4-+2H+
D. 该流程中可循环利用的物质是NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强的密闭容器中,将平均分子质量为8.5的N2和H2混合,随后在一定条件下合成氨,当反应达到平衡时测得混合气体的平均分子质量为10。
(1)反应前N2和H2的体积比为_____;
(2)氮气的平衡转化率;_____________
(3)平衡混合气中氨气的体积分数。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4,1 mol P参加反应转移的电子数为______,被氧化的磷与被还原的磷的质量比为______,1 mol CuSO4可以氧化______mol的磷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g)![]() 2CO(g)平衡常数K的表达式:K=___;
2CO(g)平衡常数K的表达式:K=___;
(2)已知某温度下,反应2SO2(g)+O2(g)![]() 2SO3(g),的平衡常数K=19。在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应___(填“是”或“否”)达到化学平衡状态,若未达到,向___(填“正反应”或“逆反应”) 方向进行。
2SO3(g),的平衡常数K=19。在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应___(填“是”或“否”)达到化学平衡状态,若未达到,向___(填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g)![]() cC(g)+dD(g) △H = m kJ·mol-1;若a+b>c+d,增大压强平衡向___(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则m___0(填“>”或“<”)
cC(g)+dD(g) △H = m kJ·mol-1;若a+b>c+d,增大压强平衡向___(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则m___0(填“>”或“<”)
(4)在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则
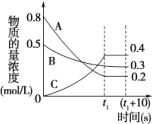
①该反应的化学方程式为:___;
②t1s时反应物A的转化率为:___;
③0~t1s内A的反应速率为v(A)=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com