
| A. | 加稀盐酸产生无色气体,将气体通过澄清石灰水中,溶液变浊,一定有SO32- | |
| B. | 加氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42- | |
| C. | 加氢氧化钠并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 某溶液焰色反应为黄色,则待测液中一定不含钾元素 |
分析 A、能够使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫;
B、氯化钡中含有钡离子和氯离子,不溶于盐酸的沉淀可能是硫酸钡,有可能氯化银;
C、铵盐和强碱溶液在加热的条件下可以发生反应生成氨气;
D、含有钠离子的溶液焰色反应为黄色,含有钾离子的溶液透过钴玻璃焰色反应为紫色.
解答 解:A、加稀盐酸产生无色气体,将气体通过澄清石灰水中,溶液变浊,可能有SO32-、CO32-、HCO3-中的至少一种都可以,故A错误;
B、加氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,产生沉淀可能是硫酸钡,还可能是氯化银,原溶液不一定有硫酸根存在,故B错误;
C、铵盐和强碱溶液在加热的条件下可以发生反应生成氨气,加氢氧化钠并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+,故C正确;
D、某溶液焰色反应为黄色,但是无法判断待测液中是否含钾元素,故D错误.
故选C.
点评 本题考查阴阳离子的检验,难度不高,注重基础知识的考查,熟悉常见离子的特征离子反应以及现象是关键.


科目:高中化学 来源: 题型:解答题
 2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.| 物质 | Cl2 | TiCl4 | O2 |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
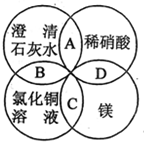 镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A. | OH-+HNO3═H2O+NO3- | B. | Ca(OH)2+Cu2+═Ca2++Cu(OH)2 | ||
| C. | Mg+Cu2+═Cu+Mg2+ | D. | Mg+2H+=Mg2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性高锰酸钾 | B. | KSCN溶液 | C. | 稀盐酸 | D. | 铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国化学家侯德榜研究了“侯氏联合制碱法”,为我国化工发展做出贡献 | |
| B. | 瑞典化学家舍勒发现软锰矿(含MnO2)与浓盐酸混合加热制得氯气 | |
| C. | 意大利物理甲阿伏伽德罗发现当光束通过胶体时可见一条光路 | |
| D. | 德国化学家哈伯在合成氨的研究中做出了巨大贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
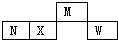 短周期主族元素M、N、X、W在元素周期表中的相对位置如图所示,N元素的单质常用作半导体材料.下列判断正确的是( )
短周期主族元素M、N、X、W在元素周期表中的相对位置如图所示,N元素的单质常用作半导体材料.下列判断正确的是( )| A. | 原子半径的大小:W>X>M | |
| B. | 气态氢化物的稳定性:N>X>M | |
| C. | 对应的含氧酸的酸性强弱:W>X>N | |
| D. | W分别与N、X形成的化合物中的化学键均为极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 |
| 甲 | -68 | 115 | 0.93 | 易溶于水 |
| 乙 | -84 | 77 | 0.90 | 易溶于甲 |
| A. | 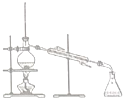 | B. | 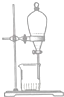 | C. | 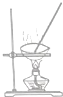 | D. | 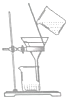 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 6种 | C. | 8种 | D. | 10种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com