
| X Y | Z |
| ①NaOH溶液 Al(OH)3 | 稀硫酸 |
| ②KOH溶液 SiO2 | 氢氟酸 |
| ③O2 N2 | H2 |
| ④FeCl3溶液 Cu | 浓硝酸 |
| A. | ①③ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
分析 ①氢氧化铝属于两性氢氧化物,能溶于强酸强碱溶液;
②二氧化硅属于酸性氧化物,能溶于强碱溶液,能和氢氟酸反应;
③氮气中N元素处于中间价态,所以具有还原性、氧化性;
④Cu易失电子作还原剂,能和强氧化剂反应.
解答 解:①氢氧化铝属于两性氢氧化物,能溶于强酸强碱溶液,所以能和强碱NaOH、强酸硫酸反应生成盐和水,故正确;
②二氧化硅属于酸性氧化物,能溶于强碱溶液生成硅酸盐和水,所以能和强碱KOH反应生成硅酸钾和水,能和氢氟酸反应生成四氟化硅和水,故正确;
③氮气中N元素处于中间价态,所以具有还原性、氧化性,高温高压催化剂条件下氮气和氢气反应生成氨气,放电条件下氮气和氧气反应生成NO,故错误;
④Cu易失电子作还原剂,能和强氧化剂反应,能和氯化铁溶液反应生成氯化亚铁和氯化铜,和浓硝酸反应生成硝酸铜、二氧化氮和水,故正确;
故选B.
点评 本题考查物质之间的反应,侧重考查学生分析判断能力,正确获取题干信息是解本题关键,注意题干中限制性条件“常温下”,为易错点.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对空气进行降温加压 | B. | 金刚石变成石墨 | ||
| C. | NaCl熔化 | D. | 碘溶于CCl4中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
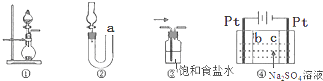
| A. | 图①可用于实验室制取少量NH3或O2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法除去Cl2中混有的HCl | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中b为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
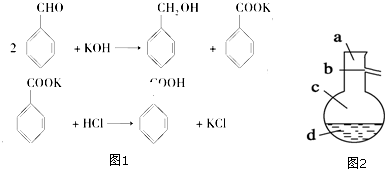
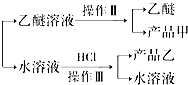
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>C>D>B | B. | A>B>C>D | C. | C>A>D>B | D. | C>B>D>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
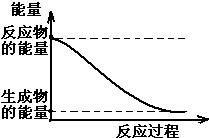 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com