

分析 含有Cr2O72-和CrO42-的废水经酸化后主要转化为Cr2O72-,Cr2O72-具有强氧化性,加入还原性的亚铁离子,将其还原为Cr3+,本身被氧化成Fe3+,然后依据溶度积常数调节pH1使Fe3+沉淀,过滤得沉淀C为Fe(OH)3,滤液含Cr3+,再依据溶度积常数调节pH2使Cr3+沉淀,据此分析解答;
(1)根据2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,酸化平衡正向移动分析;
(2)防止亚铁离子氧化,还要抑制亚铁离子水解,据此解答即可;
(3)亚铁离子具有还原性,铬酸根具有强氧化性,据此书写离子反应方程式即可;
(4)根据以上分析,沉淀C的化学式为Fe(OH)3;当离子浓度小于1.0×10-5 mol•L-1时,认为沉淀完全,据此解答即可.
解答 解:(1)因为2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,所以酸化平衡正向移动,则酸化后的溶液A显橙色;故答案为:橙;
(2)防止亚铁离子氧化,并抑制水解,则配制FeSO4溶液时,需加入少量铁粉和稀硫酸,
故答案为:铁粉、硫酸;
(3)依据分析可知:溶液A含有Cr2O72-,具有强氧化性,能氧化亚铁离子为铁离子,离子反应方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)根据以上分析,沉淀C的化学式为Fe(OH)3;当离子浓度小于1.0×10-5 mol•L-1时,认为沉淀完全,故铬离子完全沉淀时有:1×10-5×c(OH)3=1.0×10-32,解得c(OH)=$\root{3}{\frac{1.0×10{\;}^{-32}}{1×10{\;}^{-5}}}$=10-9,即pH≥5完全沉淀,所以要使Cr3+沉淀完全pH2值至少为5,故答案为:Fe(OH)3;5.
点评 本题主要考查的是金属的回收与资源利用,涉及氧化还原反应、化学反应平衡移动原理、离子反应方程式书写等,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、SO42- | B. | K+、Na+、Cl-、Cr2O42- | ||
| C. | Al3+、K+、AlO2-、Cl- | D. | Fe3+、NO3-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Al3+离子含有的核外电子数为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 10 LpH=l的硫酸溶液中含有的H+离子数为NA | |
| D. | 1L0.5mol/L的碳酸钠溶液中含有的CO32-离子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| AgNO3 | Ba(NO3)2 | AgCl | BaC12 | |
| H2O (液) | 170g | 9.2g | 1.5×10-4g | 33.3g |
| NH3(液) | 86g | 97.2g | 0.8g | 0g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
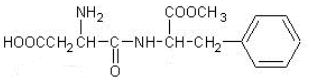
| A. | 分子式为C14H19N2O5 | B. | 既能与酸反应又能与碱反应 | ||
| C. | 不能发生水解反应 | D. | 1mol该物质最多可与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 1.0L0.1 mol•L-1 AlCl3溶液中所含的Al3+离子数为0.1NA | |
| C. | 标准状况下,11.2LSO3中含有分子数目为0.5NA | |
| D. | 常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com