
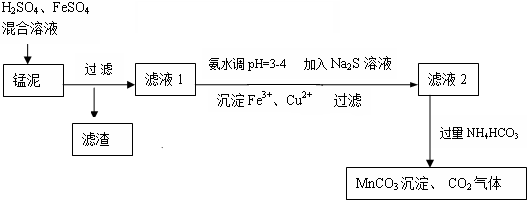
分析 H2SO4、FeSO4混合溶液与锰泥中的二氧化锰发生氧化还原反应,将亚铁氧化为三价铁,然后过滤滤去未反应掉的二氧化锰和不溶的杂质,向滤液中氨水来调节溶液的PH值,并用硫化钠来沉淀铜离子和铅离子,然后过滤滤去生成的沉淀,最后向滤液中加入过量的碳酸氢铵生成碳酸锰,
(1)粉碎软锰矿,能够增大接触面积,提高反应速率;
(2)锰泥中加入H2SO4、FeSO4混合溶液,是二氧化锰和亚铁离子发生氧化还原反应,生成铁离子,二氧化锰酸性条件下被还原;
(3)①检验Fe2+的存在加入铁氰化钾溶液,观察溶液是否变蓝;
②生产时H2SO4、FeSO4混合溶液中$\frac{c({H}^{+})}{c(F{e}^{2+})}$控制在0.7~1之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费;③若$\frac{c({H}^{+})}{c(F{e}^{2+})}$>1,调节$\frac{c({H}^{+})}{c(F{e}^{2+})}$到0.7~1的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生氧化反应,生成氢气从而消耗氢离子,而生成亚铁离子;
(4)滤液2中的锰离子与NH4HCO3反应生成碳酸锰和二氧化碳与水;
(5)锰泥中含18%的MnO2,程锰回收率可达95%,根据关系式MnO2~~MnCO3,进行计算.
解答 解:(1)粉碎软锰矿,可以增大接触面积,提高反应速率;故答案为:增大接触面积,提高反应速率;
(2)锰泥中加入H2SO4、FeSO4混合溶液,是二氧化锰和亚铁离子发生氧化还原反应,生成铁离子,二氧化锰酸性条件下被还原,所以方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)①检验Fe2+的存在加入铁氰化钾溶液,观察溶液是否变蓝,故答案为:取少量滤液1,加入铁氰化钾溶液,若无蓝色沉淀生成,证明Fe2+被氧化完全;
②生产时H2SO4、FeSO4混合溶液中$\frac{c({H}^{+})}{c(F{e}^{2+})}$控制在0.7~1之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费;
③若$\frac{c({H}^{+})}{c(F{e}^{2+})}$>1,调节$\frac{c({H}^{+})}{c(F{e}^{2+})}$到0.7~1的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生氧化反应,生成氢气从而消耗氢离子,而生成亚铁离子;
故答案为:$\frac{c({H}^{+})}{c(F{e}^{2+})}$过大,在调节pH环节会多消耗氨水;b;
(4)滤液2中的锰离子与NH4HCO3反应生成碳酸锰和二氧化碳与水,所以离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(5)锰泥中含18%的MnO2,程锰回收率可达95%,根据关系式
MnO2 ~MnCO3,
87 115
1740kg×18%×95% m,解之得m=393.3kg,
故答案为:393.3.
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写化学反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.


科目:高中化学 来源: 题型:解答题
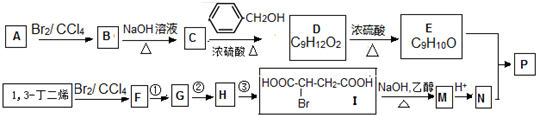
 ,
,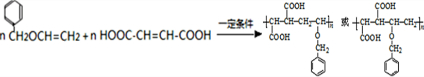 高聚物P的亲水性比由E形成的聚合物强(填“强、弱”).
高聚物P的亲水性比由E形成的聚合物强(填“强、弱”).
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
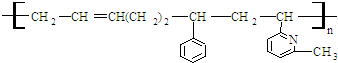
 ②CH2=CH
②CH2=CH ③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
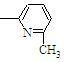 ⑥CH2=CH
⑥CH2=CH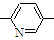 CH3
CH3| A. | ②③⑥ | B. | ②③⑤ | C. | ①②⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用化学用语回答下面的问题
用化学用语回答下面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
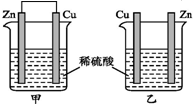
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的酸性均减弱 | D. | 产生气泡的速率甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 LCO2含有的原子数为3NA | |
| B. | 0.1 mol Na2O2固体含有的阴、阳离子总数是0.3NA | |
| C. | 1.8gNH4+含有的质子数为NA | |
| D. | 标准状况下,2.24 L NO与1.12 L O2混合,所得气体中分子数为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com