
下列有关元素化合物的性质叙述正确的是
A.SO2、NO2都能与水反应,其反应原理相同
B.Na2O2在空气中长期放置最终变为NaHCO3粉末
C.既能与酸反应;又能与碱反应的物质都是两性化合物
D.可用KSCN溶液检验FeSO4溶液是杏氧化变质
科目:高中化学 来源: 题型:
乙酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,已知苯胺微溶于冷水;纯乙酰苯胺是无色片状晶体,熔点114℃,不溶于冷水,可溶于热水;乙酸酐遇水缓慢反应生成乙酸;现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
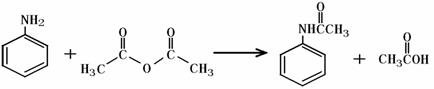 |
实验步骤
① 取5.0 mL苯胺(密度1.04 g/mL),倒入100 mL锥形瓶中,加入20 mL水,在旋摇下分批加入6.0 mL乙酸酐(密度1.08 g/mL),搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
② 反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③ 将粗产品转移至150 mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5 min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品。
(1)步骤①研碎块状产物的用意在于 ;反应温度过高会导致苯胺挥发,下列可以控制反应温度,防止反应温度升高过快的操作有 ;
A.反应快结束时的充分搅拌 B.旋摇下分批加入6.0 mL乙酸酐
C.玻璃棒将块状物研碎 D.加20ml水
(2)步骤②洗涤粗产品时,选用的溶剂是 ;
A.热水 B.冷水 C.1:3的乙醇溶液 D.滤液
(3)步骤③两次用到过滤,其中过滤Ⅰ选择 (过滤、趁热过滤或抽滤),过滤Ⅰ操作是为了除去 ;配制热溶液时,加入过量溶剂的作用是
(选出正确选项);
A.防止后续过程中,溶剂损失可能产生的产物析出
B.防止后续过程中,温度降低可能产生的产物析出
C.除去活性炭未吸附完全的有色杂质
(4)步骤③冷却滤液时可选择 ;
A.冰水浴冷却 B.搅拌下水浴冷却
C.室温下自然冷却 D.投入少量碎冰后静置
(5)步骤③中以下哪些操作不能提高产率 ;
① 配制成饱和溶液后,加入过量20%的溶剂;② 趁热过滤近沸溶液;③ 过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;④ 加活性炭吸附;⑤ 过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体。
A.①④⑤ B.①④ C.④⑤ D.②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75g,已知苯胺、乙酸酐和乙酰苯胺的摩尔质量分别为93g/mol、102g/mol、135g/mol。该实验的产率为 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)绿色食品是指( )
A.绿颜色的营养食品 B.有叶绿素的营养食品
C.附加值高的营养食品 D.安全、无公害的营养食品
(2)下列垃圾中,不适合用卫生填埋、焚烧、堆肥等处理方法处理的是( )
A.腐败食品 B.电池 C.卫生纸 D.纯棉纺织品
(3)葡萄糖能发生银镜反应说明其结构中含有 基。
(4)维生素C可以与酸性高锰酸钾溶液反应,高锰酸钾中的锰元素生成正二价锰离子,那么维生素C发生了 (填“氧化”或“还原” )反应
(5)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和 (写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(6)氨基酸是组成蛋白质的基本结构单元,人体中共有二十多种氨基酸,其中人体自身
___ (填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明亚硫酸的酸性强于碳酸的是
A.饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH
B.亚硫酸能使酸性高锰酸钾溶液褪色,而碳酸不能
C.同温下,等浓度的亚硫酸氢钠和碳酸氢钠溶液,碳酸氢钠溶液的碱性强
D.将过量二氧化硫气体通入碳酸氢钠溶液中,逸出的气体能使澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成
FeCl3.nH2O。
(1)实验室用如下装置(部分加热、夹持等装置已略去)制备无水氯化铁固体。
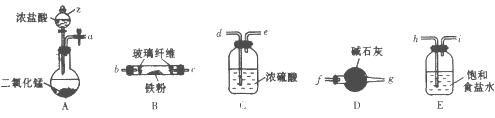
①装置A中仪器z的名称是___________。
②简述检验装置A气密性的操作:______________________。
③按气流方向连接各仪器接口,顺序为a→_________ →__________ →_________ →__________→b→c→_________→__________,装置D的作用是______________________。
(2)工业上制备无水的一种工艺流程如下:
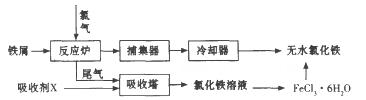
①吸收塔中发生反应的离子方程式为_________________________________________。
②简述由FeCl3.6H2O晶体得到无水氯化铁的操作:________________________________。
③用碘量法测定所得无水氯化铁的质量分数:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容;取出10 mL,加入稍过量的KI溶液,充分反应后,滴入指示剂_________(填试剂名称),用c mol 的Na2S2O3溶液进行滴定,终点时消耗V mLNa2S2O3溶液(已知:
的Na2S2O3溶液进行滴定,终点时消耗V mLNa2S2O3溶液(已知: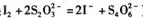 )。则样品中氯化铁的质量分数为____________。
)。则样品中氯化铁的质量分数为____________。
(3)若已知:

请写出Fe3+发生水解反应的热化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(NA表示阿伏加德罗常数)( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1molHe含有的原子数为NA
C.71gCl2所含原子数为2 NA
D.23g钠在化学反应中失去电子数目为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A B(在水溶液中进行)。其中,C是溶于水显酸性的气体,D是淡黄色固体。写出C的结构式: ;D的电子式: 。
B(在水溶液中进行)。其中,C是溶于水显酸性的气体,D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。(用离子方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com