
(1)某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、S042-、NO3-和NO2-等.为确定其组成,分别进行下列4组实验,其中能确认样品中不含SO32-的实验操作是________(填下列实验操作序号);根据实验结果,你认为是否含有NO2-?________(填“含有”、“不含有”),其原因是________;
A.取试样,滴加适量的淀粉KI溶液,呈蓝色:
B.取试样,滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
C.取试样,滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝:
D.取试样,滴加酸性KMnO4溶液,不褪色.
(2)某溶液含两种相同物质的量的溶质,且溶液中只存在OH-、H+、NH4+、Cl-四种离子,其中c(NH4+)>c(Cl-)则这两种溶质的化学式分别是________.
(3)已知25℃时Ksp(RX)=1.8×10-10,Ksp(RY)=1.8×10-16,Ksp(R2Z)=1.8×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是________.
科目:高中化学 来源: 题型:阅读理解
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸盐化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加溶液,加热,加入的氢氧化钠溶液体积(V)与生成的沉淀、产生的气体关系(n)如右图. |  |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO2)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(SO2)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体(n)的关系如图 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题
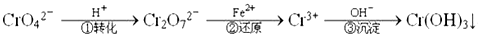
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O  Cr3+(aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_____。
Cr3+(aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_____。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com