
| A. | H2和D2互为同位素 | B. |  和 和 互为同分异构体 互为同分异构体 | ||
| C. | 甲烷与乙烯是同系物 | D. |  和 和 是同一种物质 是同一种物质 |
分析 A.具有相同质子数、不同中子数的原子之间互为同位素,同位素的研究对象为原子;
B.甲烷为正四面体结构,二者为同一种物质;
C.同系物必须具有相似结构,甲烷和乙烯的结构不同;
D.二者分子式、结构完全相同,为2-甲基丁烷.
解答 解:A.H2和D2为氢气单质,不属于同位素,故A错误;
B. 和
和 都是2,2-二溴甲烷,为同一种物质,故B错误;
都是2,2-二溴甲烷,为同一种物质,故B错误;
C.甲烷为饱和烃,乙烯为烯烃,二者结构不同,不属于同系物,故C错误;
D. 、
、 结构相同、分子式相同,属于同一种物质,故D正确;
结构相同、分子式相同,属于同一种物质,故D正确;
故选D.
点评 本题考查了同位素、同分异构体、同系物等的判断,题目难度不大,明确“五同”的概念为解答关键,注意掌握同位素与同素异形体的区别,试题侧重考查学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题

| A. | 步骤①③均发生了置换反应 | B. | 步骤③中SO2被还原 | ||
| C. | 步骤②③的目的是富集溴元素 | D. | 步骤④利用了溴易挥发的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
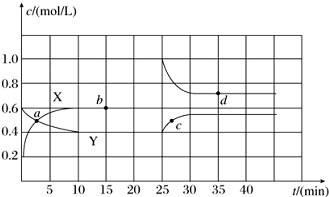
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | 碳酸钠溶液水解的离子方程式:CO32-+2H2O?H2CO3+2OH- | |
| C. | 氢气的燃烧热为285.8 kJ/mol,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | |
| D. | 浓盐酸与MnO2共热制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 某物质做焰色反应时,火焰呈黄色,则该物质中肯定不存在钾元素 | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
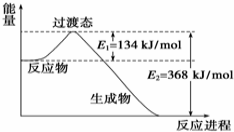 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填“大于”、“小于”或“等于”)CO2和NO的总能量.
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填“大于”、“小于”或“等于”)CO2和NO的总能量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com