
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.某二元弱酸的酸式盐NaHA溶液中:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
B.0.2 mol/L NH4Cl溶液和 0.1 mol/L NaOH溶液等体积混合:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D.25℃时,pH=8的CH3COONa稀溶液中:c(CH3COOH)=9.9×10-7 mol/L
科目:高中化学 来源:2014年高考化学苏教版总复习10-1化学实验常用仪器和基本操作练习卷(解析版) 题型:选择题
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种功能的装置。下列各图中能用作防倒吸安全瓶的是( )
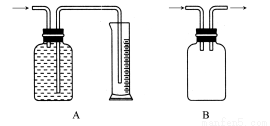
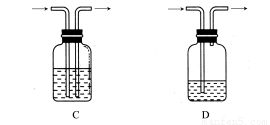
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油质量的措施,常用催化重整。关于以下两个在催化重整时发生的反应:
①
②
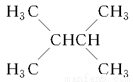
下列叙述不正确的是( )
A.石油分馏后得到的汽油等轻质油远不能满足需求,故常用裂化等方法生产更多的轻质油
B.使用含铅抗爆剂,会导致铅污染,故目前已禁止使用
C.①②均为消去反应
D.①②反应过程中有机物碳原子数均没有发生变化
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
A.溶液中所含溶质的离子浓度大小关系为: c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+)
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:填空题
Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?________。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是________。
c(Na+)-c(A-)=________mol·L-1
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-、HB- H++B2-。
H++B2-。
回答下列问题:
(5)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
下列离子方程式中,能正确表示盐的水解反应的是( )
A.NH4++H2O NH3·H2O+H+
NH3·H2O+H+
B.Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C.S2-+2H2O H2S+2OH-
H2S+2OH-
D.Br-+H2O HBr+OH-
HBr+OH-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:填空题
某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是______________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol·L-1
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:填空题
强酸制弱酸是复分解反应的一条重要规律。这里的“强酸”、“弱酸”指相对强弱,能呈现酸性的一些非酸类物质,如酚类、两性氢氧化物、酸式盐等参与的反应也可根据其酸性强弱运用上述规律来判断其产物。
(1)HA、H2B是两种弱酸,有如下关系:H2B(少量)+2A-=B2-+2HA,则A-、HB-、B2-三种离子中,最易结合质子(H+)的是________。
(2)酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。在液氨中CH3COONa+HCl―→NaCl+CH3COOH这一反应能否发生________(填“能”或“否”),理由是____________________。
(3)某同学实验发现,将H2S气体通入CuSO4溶液中,生成黑色沉淀。弄清沉淀是CuS后,写出了化学方程式:H2S+CuSO4=CuS↓+H2SO4。但随后他陷入了困惑:这不是弱酸制得强酸了吗?与强酸制弱酸的规律矛盾了。请你帮助解释__________________________________________。
(4)氧化还原反应中也有类似规律:“强氧化性物质制弱氧化性物质”、“强还原性物质制弱还原性物质”,据此判断下列反应能够发生的是________(填字母编号)。
A.FeCl2+Cl2 FeCl3
FeCl3
B.Fe+I2 FeI3
FeI3
C.Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
D.FeCl3+Cu CuCl2+FeCl2
CuCl2+FeCl2
E.FeBr3+Cl2 FeCl2+Br2
FeCl2+Br2
F.FeI2+Br2 FeBr3+I2
FeBr3+I2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
某温度时,在体积为1 L的密闭容器中,A、B、C三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,B的体积百分含量与时间关系如图Ⅱ所示。则下列结论正确的是( )
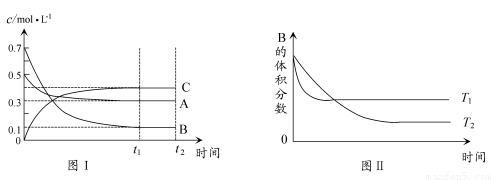
A.该反应的热化学方程式为 :A(g )+3B(g) 2C(g) ΔH>0
2C(g) ΔH>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com